微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)
(1)等物质的量的A和B,混合于2L的密闭容器中,发生反应3A(g)+B(g)=xC(g)+2D(g),经过5min时,测得D的浓度为1mol/L,c(A):c(B)=3:4,C的反应速率是0.2mol?L-1?min-1,A在5min末的浓度是______,x的值是______.
(2)1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图(各物质为气体)
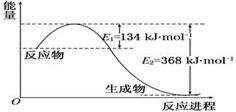
写出NO2和CO反应的热化学方程式____________________
(3)已知可逆反应:M(g)+N(g)  P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为____
②平衡后,升高温度,平衡常数 。(增大、减小)
(4)t ℃时,水的离子积常数为1×10-13,则该温度 25℃(填大于,小于)。若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(忽略混合后体积变化),若所得混合液为中性,则a :b= 。
(5)已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=5.6×10-5 ,求此温度下该反应 的平衡常数K的数值为____
的平衡常数K的数值为____
2、填空题 (1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为?。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是?(用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N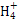 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
3、选择题 在平衡体系Ca(OH)2(s) 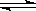 Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
A.加入少量MgCl2固体
B.加入少量Na2CO3固体
C.加入少量KCl固体
D.加入少量Ba(OH)2固体
4、选择题 已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是
A.1.36×10-5 mol·L-1
B.8.90×10-6 mol·L-1
C.4.45×10-2 mol·L-1
D.1×10-5 mol·L-1
5、填空题 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。

3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+__________+_________
②5Ca(OH)2+3H3PO4=_________________
(2)与方法A相比,方法B的优点是____________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因
_________________________________。