微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子中无中子,A与D同主族.B元素的氢化物水溶液能使红色石蕊试纸变蓝,C与E同主族,D与E同周期,E原子的最外层电子数等于两个内层电子数之差.回答下列问题:
(1)写出D元素的名称:______;比较原子半径B______C(填“>”或“<”);
(2)由A、C、D元素形成的化合物中含有的化学键是______;
(3)化合物A2C的电子式为______;
(4)物质M由B元素的氢化物和最高价氧化物的水化物反应得到,则M属于______晶体(填原子、分子或离子);
(5)由A、C形成的化合物和C、E形成的化合物发生反应只生成强酸,其化学方程式为______.
参考答案:A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子中无中子,则A为氢元素;A与D同主族,D的原子序数与氢元素原子序数之差大于2,故D为Na元素;B元素的氢化物水溶液能使红色石蕊试纸变蓝,溶液呈碱性,故B为氮元素;D与E同周期,常用第三周期,E原子的最外层电子数等于两个内层电子数之差,则E原子最外层电子数为8-2=6,故E为硫元素,C与E同主族,故C为氧元素,
(1)由上述分析可知,D为钠元素;同周期自左而右原子半径减小,故原子半径N>O,
故答案为:钠;>;
(2)H、O、Na三种元素组成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,故NaOH中存在离子键、共价键,
故答案为:离子键、共价键;
(3)H2O分子中氧原子与氢原子之间形成1对共用电子对,氧原子有2对孤电子对,电子式为
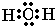
,
故答案为:
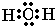
;
(4)物质M由N元素的氢化物和最高价氧化物的水化物反应得到,则M为硝酸铵,属于离子晶体,
故答案为:离子;
(5)由H、O形成的化合物和O、S形成的化合物发生反应只生成强酸,故生成硫酸,应为三氧化硫与水反应,或过氧化氢与二氧化硫反应,化学方程式为:H2O+SO3=H2SO4或H2O2+SO2=H2SO4,
故答案为:H2O+SO3=H2SO4或H2O2+SO2=H2SO4.
本题解析:
本题难度:一般
2、选择题 下列化学用语中,正确的是
[ ? ]
A.甲烷的结构式: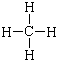
B.镁的原子结构示意图: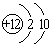
C.氯化钠的电子式: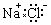
D.乙烷的结构式:CH3CH3
参考答案:A
本题解析:
本题难度:简单
3、简答题 化学键的键能是指气态原子间形成1mol化学键时释放的能量.如:H(g)+I(g)=H-I(g);△H=-297kJ?mol-1,即H-I键的键能为297kJ?mol-1,也可以理解为破坏1mol?H-I键需要吸收297kJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.(单位:kJ?mol-1)
| 键能 | | 键能 | | 键能
H-H
436
Cl-Cl
243
C-F
427
H-N
393
H-O
?
H-F
565
C-Cl
330
H-S
339
H-Cl
431
C-O
347
C-I
218
H-Br
366
|
阅读上述信息,回答下列问题:
(1)你认为键能与物质的热稳定性的关系是:______.
所以CF4的化学稳定性比CCl4______(填“强”或“差”或“相同”)
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q?kJ?mol-1;通过计算确定热化学方程式中Q的值为______.
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:______.由此可推出H-O键的键能最佳估值范围为:______kJ?mol-1<E(H-O)<______kJ?mol-1.
参考答案:(1)键能越大,破坏该键越难,即该键越稳定;C-F键的键能大于C-Cl键的键能,所以CF4的化学稳定性比CCl4强.
故答案为:键能越大,物质的热稳定性越强;强.
(2)Q=生成物的键能减反应物的键能=2×431?kJ?mol-1-436kJ?mol-1-243kJ?mol-1=183kJ?mol-1
故答案为:183;
(3)根据图表知,H-Br、H-Cl、H-F的键能依次增大,Br、Cl、F的原子半径依次减小,键长依次减小,所以原子半径越小,形成的键长越短,键长越短键能越大;
根据原子半径与键长、键能的关系知,H-O键的键能应小于H-F键的、大于H-H减的键能.
故答案为:原子半径越小,形成的键长越短,键长越短键能越大;
393?kJ?mol-1<E(H-O)<565?kJ?mol-1
本题解析:
本题难度:一般
4、选择题 下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
A.6 和8
B.11 和13
C.11 和16
D.12 和17
参考答案:D
本题解析:
本题难度:简单
5、选择题 C60是具有空心的类似足球状结构的分子。下列有关C60的叙述,正确的是
A.C60是一种新型化合物
B.C60中含有非极性键
C.C60中含离子键
D.C60和金刚石都是碳的同位素
参考答案:B
本题解析:
正确答案:B
A、不正确,C60是一种单质;? B.正确,C60中含有非极性键,C―C成键的两个原子相同;
C.不正确,C60中含共价键; D.不正确,C60和金刚石都是碳的同素异形体。
本题难度:一般