微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,将稀CH3COOH逐滴加入到稀NaOH溶液中,当溶液的pH=7时,下列关系不正确的是
A.c(CH3COO-)+ c(CH3COO-)=c(Na+)
B.c(OH-) = c(H+)
C.c(CH3COO-) +c(H+)= c(Na+) +c(OH-)
D.c(Na +)=c(CH3COO-)
参考答案:A
本题解析:
根据电荷守恒,有c(CH3COO-)+ c(CH3COO-)=c(Na+)+ c(H+), 25℃时,pH=7,则c(OH-) = c(H+)=10-7mol/L,由此可得c(Na +)=c(CH3COO-) ,BCD正确,A错,故选A。
本题难度:简单
2、选择题 已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度大小顺序为 或 或 。c点溶液中的离子浓度大小顺序为 。
(3)a、b、c三点中水的电离程度最大的是 ,滴定过程中宜选用 作指示剂。
参考答案:(1)4×10-4 mol·L-1
(2)c(CH3COO-)>c(H+)>c(K+)>c(OH-)
c(CH3COO-)>c(H+)=c(K+)>c(OH-)
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
c(K+)=c(CH3COO-)>c(H+)=c(OH-)
(3)c 酚酞
本题解析:(1)c(H+)=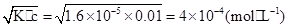
(2)b点时,由于滴加KOH溶液的体积未知,因此,溶液中的c(K+)与c(H+)相对大小未知,所以有3种可能情况。c点时可根据电荷守恒得出关系式。
(3)酸性溶液中水的电离被抑制,加入可水解的盐能促进水的电离,随着KOH的加入(c点时,KOH还未过量),溶液中CH3COOK的量不断增多,因此水的电离过程不断增大,故c点符合题意。由于酸碱恰好完全反应时溶液显碱性,故应该选择碱性范围内变色的指示剂酚酞。
本题难度:一般
3、选择题 下列离子方程式中,属于水解反应的是
[? ]
A.HCOOH+H2O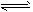 HCOO-+ H3O+
HCOO-+ H3O+
B.CO2+H2O HCO3-+ H+
HCO3-+ H+
C.CO32-+H2O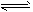 HCO3-+OH-
HCO3-+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:
本题难度:简单
4、填空题 (12分)(1)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是 。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH= 。
(4)常温下,将0.1000 mol L-1 NaOH溶液滴入20.00 mL 0.1000 mol L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+) c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为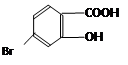 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。
参考答案:(1) Fe3+ + 3H2O  Fe(OH)3 + 3H+(2分)
Fe(OH)3 + 3H+(2分)
Fe3+ + 3HCO3- = Fe(OH)3 ↓ +3CO2 ↑(2分)
(2) Fe(OH)3溶度积(或溶解度)比Mg(OH)2更小(2分)(3)11 (2分)(4)>(2分)网]
(5)羟基(1分)、羧基(1分)(若写了溴原子,不给分)
本题解析:双水解产生沉淀和气体,SFe(OH)3<SMg(OH)2 C(OH-)=10-2×0.1mol+10-4mol×1/1.1L
完全反应生成强碱弱酸盐显碱性。c(Na+) > c(A-)。
本题难度:一般
5、选择题 为配置NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
① 适量HCl ② 适量NaCl ③ 适量氨水 ④ 适量NaOH
A.①②
B.③
C.③④
D.④