微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 根据以下事实,回答下列问题
(1)工业接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1该热化学反应方程式的意义是______.
(2)在25℃、101kPa下,1g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热.22.68kJ.则表示甲醇燃烧热的热化学方程式为______.
(3)已知25℃、l01kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为______.
(4)由N2和H2合成1molNH3时可放出46.2kJ的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是______.
参考答案:(1)该热化学方程式的意义是:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ,
故答案为:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,则表示燃烧热的热化学方程式为:CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1,
故答案为:CH3OH(l)+32O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1;
(3)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol,
根据盖斯定律,②×2+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
(4)N2和H2合成NH3的方程式为:N2+3H2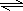 2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,
2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,
1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ?mol-1+3×436.0kJ?mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则6mol×x-2256.9kJ=92.4kJ,解得x=391.6kJ/mol,
故答案为:391.6kJ/mol;
本题解析:
本题难度:一般
2、填空题 (1)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气.已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
则肼与二氧化氮反应的热化学方程式为:______
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点.氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O.酸式氢氧燃料电池的电解质溶液是强酸溶液,负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为______;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e-=4OH-,则其负极反应式为______.
参考答案:(1)25℃时,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.氢氧化铜的溶度积常数小于氢氧化镁的溶度积常数.
所以在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成氢氧化铜沉淀.
反应的化学方程式是:CuCl2+2NH3?H2O=Cu(OH)2↓+2NH4Cl,NH3?H2O是弱碱,不能拆,Cu(OH)2是弱碱不能拆.
故离子方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2 ; Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+;
(2)根据盖斯定律,将(2×①)+(2×②)可知:
肼与二氧化氮反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol;
(3)氢氧燃料电池无论是酸式还是碱式,其电池总反应均为:2H2+O2=2H2O ①
酸式氢氧燃料电池负极电极反应式为:2H2-4e-=4H+②
用(①-②)即得酸式氢氧燃料电池的正极反应:O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的正极电极反应式为:O2+2H2O+4e-=4OH-③
用(①-③)即得:2H2-4e-+4OH-=4H2O,故碱式氢氧燃料电池的负极反应:H2-2e-+2OH-=2H2O,
故答案为:O2+4e-+4H+=2H2O;H2-2e-+2OH-=2H2O.
本题解析:
本题难度:一般
3、填空题 氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.
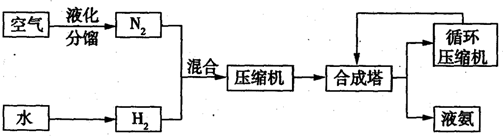
(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是______.
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气
沸点/℃
-196
-183
-269
-264
-186
-153
-108
|
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤
相对投资费用
1.0
1.5
2.0
能量消耗/J-t-1
28×109
38×109
48×109
|
①依据上表信息,你认为采用______为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:______.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ-mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ-mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ-mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式______.
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
NH3含量%
压强/MPa
温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100
200
15.3
81.5
86.4
89.9
95.4
98.8
300
2.2
52.0
64.2
71.0
84.2
92.6
400
0.4
25.1
38.2
47.0
65.2
79.8
500
0.1
10.6
19.1
26.4
42.2
57.5
600
0.05
4.5
9.1
13.8
23.1
31.4
|
①依据表中数据判断,合成氨反应N2+3H2

2NH3的△H______(填“>”、“<”或“无法判断”)0,请简要说明理由______;
②该反应的化学平衡常数表达式为______.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的______倍.
参考答案:(1)液态气体升高温度时,氦气沸点最低,先变为气体,故答案为:氦气;
(2)①用天然气合成氢气,投资最少,费用最低,应是最好的,故答案为:天然气;
②甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳,则反应的化学方程式为CH4+H2O?催化剂?.高温?CO+3H2,
故答案为:CH4+H2O?催化剂?.高温?CO+3H2;
③已知①C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
利用盖斯定律将①-12×②-12×③可得:C(s)+H2O(g)=CO(g)+H2(g)
△H=(-394kJ?mol-1)-12×(-566kJ?mol-1)-12×(-484kJ?mol-1)=+131kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1;
(3)①由表中数据可知,在相同温度下升高温度氨气的含量减小,说明平衡向逆反应方向移动,说明逆反应吸热,正反应放热,则△H<0,
故答案为:<;相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热;
②根据化学方程式可写出平衡常数为k=c2(NH3)c(N2)?c3(H2),故答案为:c2(NH3)c(N2)?c3(H2);
③N2+3H2
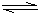
2NH3
起始:1?3? ? 0
转化:x?3x?2x
平衡:1-x?3(1-x)? 2x
2x1-x+3(1-x)+2x=0.52,
x=0.68,
则混合气体的体积是反应开始时的4-2×0.684=0.66,
故答案为:0.66.
本题解析:
本题难度:一般
4、选择题 一定条件下发生反应A(g)+3B(g) = 2C(g);△H =" a" kJ·mol-1,现有1molA(g)和3molB(g)反应生成2molC(g),反应过程能量变化如图所示,

下列说法正确的是
A.该反应为放热反应,a=E1-E3。
B.该反应为放热反应, a=E2-E1
C.该反应为放热反应, a=△E1-△E2
D.该反应为吸热反应, a=△E2-△E1