微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:

(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
温度/℃
| 0
| 10
| 20
| 30
| 50
| 80
| 100
|
溶解度(g/100gH20)
| 74.4
| 81.9
| 91.8
| 106.8
| 315.1
| 525.8
| 535.7
|
?从FeCl3溶液中获得FeCl3·6H2O的方法是:?。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:?。
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ?mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为:? ?。
③某同学根据上述方案,使用上述(2)中获得的FeCl3·6H2O样品代替无水氯化铁样品进行测定。通过计算发现产品中的质量分数大于100%,其原因可能是?。
参考答案:(1)2Fe2++Cl2=2Fe3++2Cl-(2分)
(2)加入少量盐酸加热浓缩,再冷却结晶(3分)
(3)Fe2Cl6(2分)
(4)1.1×10-6?(2分)
(5)①滴入最后一滴,溶液颜色由蓝色变为无色。(2分)
②162.5Vc/m %(2分)
③FeCl3·6H2O烘干时失去了部分结晶水(2分)
本题解析:略
本题难度:一般
2、填空题 某兴趣小组根据金属镁与C02的反应,推测金属钠也能与C02发生反应,因此
他们用下图所示的装置进行“钠与C02反应”的探究(尾气处理装置略去).又知实
验过程中的C02气体为足量;设能发生的反应都进行完全;一氧化碳气体可用氯化钯
(PdCl2)溶液来检验(通过溶液颜色的变化来判断)。
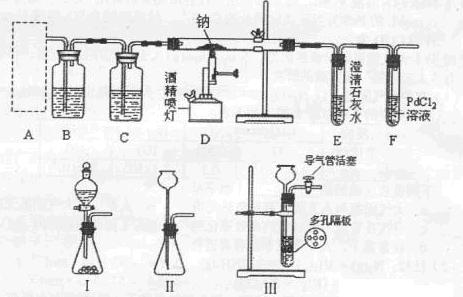
(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是?(填“I”、“Ⅱ”或“Ⅲ”).若要用干燥、纯净的C02气体与金属钠反应,则装置B中应盛放的试剂是?溶液。
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必须进行的实验操作是?。
(3)反应完成后,装置D玻璃管中残留的固体物质可能是?。(填字母)
 .Na202? b.Na2C03? c.NaHCO3? d.Na2C03和C
.Na202? b.Na2C03? c.NaHCO3? d.Na2C03和C
(4)若D玻璃管中残留的固体是纯净物,则钠与C02反应的化学方程式是?。
(5)请设计合理的实验来检验某固体物质是Na2C03.答:?。
参考答案:(1)Ⅲ?饱和NaHCO3?(2)打开Ⅲ的导气管活塞(先通一会CO2气)?(3)b
(4)2Na +2CO2 Na2CO3 + CO
Na2CO3 + CO
(5)取少量固体进行焰色反应,火焰呈黄色。再取少量固体跟适量CaCl2溶液反应,有白色沉淀生成。取少量固体跟稀盐酸反应,产生无色无味气体
本题解析:略
本题难度:一般
3、选择题 下列装置合理,且能达到实验目的的是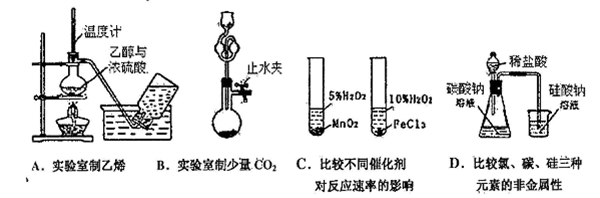
参考答案:B
本题解析:略
本题难度:一般
4、实验题 (16分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应?
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ? ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
实验步骤(不要求写具体操作过程)
| 预期现象和结论
|
①测定上述实验用的Fe(NO3)3溶液的pH值
| ?
|
②
参考答案:(16分)(1)c?(2分)
(2)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡(2分)?溶液的紫红色褪去(2分)(或其它方法,但操作要与现象一致,否则只给操作分)
Fe3++Ag= Fe2++Ag+?(2分)
(3)4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O(2分)
实验步骤(不要求写具体操作过程)
预期现象和结论
①
若银镜消失,假设②成立。(2分)
若银镜不消失,假设②不成立。(2分)
②配制相同pH值的稀硝酸溶液,并将适量此溶液加入有银镜的试管内(2分)
本题解析:(1)ab中均会产生污染性气体,且原料利用率不高。选项c中产生的污染性气体最少,原料利用率高,答案选c。
(2)亚铁离子的检验常用酸性高锰酸钾溶液溶液,即)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡,溶液的紫红色褪去,即说明含有亚铁离子。铁离子氧化单质银的方程式为Fe3++Ag= Fe2++Ag+。
(3)在酸性条件下NO3-能氧化Ag,反应的方程式为4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O。由于乙同学放弃了检验NO3-在不同条件下的还原产物的方法,所以可以通过配制相同pH的硝酸溶液来和银反应,从而检验在此酸性条件下NO3-是不是能氧化Ag。
本题难度:一般
5、实验题 (16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:?0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有?中的一种或两种。
【实验探究】
?
| 实验操作
| 预期现象
| 结?论
| 验证猜想Ⅰ
| 步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液
| ?
| ?
| 步骤②:?
| ?
| 含有Fe3+
| 验证猜想Ⅱ
| 将所得气体通入如下装置
| ?
| 含有两种气体
|

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:?
?。
参考答案:(16分)SO2、H2?(2分)
猜想Ⅰ
步骤①溶液紫红色褪去?(2分)?含有Fe2+(2分)
步骤②另取少量所得溶液,滴加KI溶液和淀粉溶液?(2分)?溶液变为蓝色(2分)
猜想Ⅱ
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体(3分)
不正确(1分)。若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+(2分)
本题解析:略
本题难度:简单
|