1、选择题 已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:
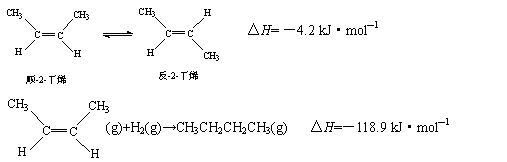
下列说法正确的是(?)
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯不能使溴水褪色
参考答案:B
本题解析:顺-2-丁烯转化为反-2-丁烯的反应是放热反应,这说明顺-2-丁烯的能量比反-2-丁烯的能量高,所以反-2-丁烯比顺-2-丁烯稳定,A不正确,B正确;该反应是体积不变的可逆反应,所以改变压强破坏不移动,C不正确;反-2-丁烯含有碳碳双键,也能使溴水褪色,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练,主要是考查学生灵活运用基础知识解决实际问题的能力,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
2、选择题 热化学方程式 2H2(气) + O2(气) = 2H2O(气),△H=- 483.6 kJ/mol ,其中化学计量(系数)表示的是(?)
A.体积数
B.物质和质量
C.物质的量
D.物质的质量
参考答案:C
本题解析:在热化学方程式中化学计量数表示参加反应的物质的物质的量,答案选C。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固与训练,有助于调动学生的学习兴趣,提高学生的学习效率。
本题难度:简单
3、选择题 已知2H2(g) + O2(g) = 2H2O(l)?ΔH =" -" 571.6 kJ/mol
H2O(l) = H2O(g)?ΔH =" +" 44 kJ/mol?下列说法中,不正确的是
A.H2的燃烧热为285.8 kJ/mol
B.2H2(g) + O2(g) = 2H2O(g)ΔH =" -" 483.6 kJ/mol
C.1 mol H2完全燃烧生成气态水放出的热量大于285.8 kJ
D.形成1 mol H2O的化学键释放的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
参考答案:C
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项A正确;根据盖斯定律可知,选项B正确;由于气态水的能量高于液态水的能量,所以氢气燃烧生成液态水放热多,选项C不正确;反应热还是断键吸收的能量和形成化学键所放出的能量的差值,选项D正确,答案选C。
本题难度:一般
4、选择题 中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是(?)
A.1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液
B.1mol/L的稀H2SO4溶液与1mol/L的稀Ba(OH)2溶液
C.1 L 1mol/L的稀HCl溶液与2 L 1mol/L的稀NaOH溶液
D.1 L 1mol/L的稀H2SO4溶液与1 L 1mol/L的稀Ba(OH)2溶液
参考答案:C
本题解析:中和热是指酸碱发生中和反应生成1mol H2O时所放出的热量,它是一个固定值,为57.3kJ/mol。A项,由于未明确盐酸和NaOH溶液的体积,故1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液混合产生H2O的物质的量不确定,故A项错误。同理,可以得出B项也错误。C项,1 L 1mol/L的稀HCI溶液与2 L 1mol/L的稀NaOH反应,HCl不足,NaOH过量,计算得生成的H2O的物质的量为1mol,故C项正确。D项,反应生成的H2O的物质的量为2mol,产生的热量应等于114.6kJ,同时SO42-与Ba2+结合生成BaSO4会放出热量,即总热量应大于114.6kJ,故D项错误。
本题难度:一般
5、填空题 (15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为?。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=?。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为?? (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b?、
c?。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
?;实验a和c的平衡转化率:αa为?、αc为?。
参考答案:
⑴AX3(l)+X2(g) = AX5(s) ?ΔH=-123.8KJ·mol-1(2分)
⑵① (3 分)
(3 分)
②bca(2分) b、加人催化剂。反应速率加快,但平衡点没有改变(2分)
c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)(2分)
③α=2(1- ) (2分)? 50%(1分)?40% (1分)
) (2分)? 50%(1分)?40% (1分)
本题解析:⑴据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
⑵①
解:开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为: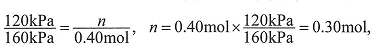
AX3(g) + X2(g)? ?AX5(g)
?AX5(g)
起始时no/mol:? 0.20? 0.20? 0
平衡时n/mol:: 0.20 -x? 0.20 -x? x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10
 ?
?
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g)?+? X2(g)? ?AX5(g)
?AX5(g)
起始时no/mol:? 0.20? 0.20? 0
变化量n/mol::? 0.20α? 0.20α? 0.20α
平衡时n/mol:: 0.20 -0.20α? 0.20 -0.20α? 0.20α
据题意有 ,化简得α=2(1-
,化简得α=2(1- );
);
将图中p0、p的数据代入上述计算式得αa=2(1- )=2(1-
)=2(1-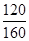 )=50%;
)=50%;
αc=2(1- )=2(1-
)=2(1-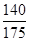 )=40%。
)=40%。
本题难度:一般