1、选择题 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4?(g)+ 2H2O?(g)  CO2(g)+4H2?(g)
CO2(g)+4H2?(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键
| C—H
| O—H
| C=O
| H—H
|
吸收热量(kJ/mol)
| 414
| 464
| 803
| 436
|
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是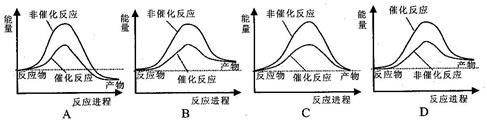
参考答案:B
本题解析:使用催化剂,使物质达到成为活化分子的所需能量降低,也就增多了活化分子数目,使化学反应速率加快,达到化学平衡所需的时间缩短,根据表中数据经过计算产物的总能量高于反应物的总能量,故选B。
点评:本题考查的是影响化学反应速率的因素,以催化剂为例,催化剂会加快化学反应的速率,缩短达到化学平衡所需的时间。
本题难度:简单
2、选择题 化学与生活密切相关,结合学过的化学知识,判断下列结论不正确的是
A.室内空气污染之一主要是来自绝缘材料、化纤、油漆等装饰材料释放的甲醛气体
B.用明矾净水是因为Al3+水解生成的Al(OH)3沉淀具有表面积大、吸附性强的特征
C.经卫生防疫部门检验合格的猪肉往往盖上蓝色的检验印章,此印色部分也可以食用
D.人工增雨作业、防雹作业时火箭弹中发射的碘化银,不会造成环境重金属污染
参考答案:B
本题解析:分析:A、一些装饰材料、化纤地毯、涂料油漆等会不同程度地释放出甲醛气体,而使室内空气中甲醛含量超标,成为室内空气污染的主要原因之一.
B、明矾净水作用是利用铝离子水解形成的胶体具有吸附杂质的作用;
C、品质验讫章和检疫验讫章所用印油均为符合食品卫生要求的可食用颜料,安全无毒;
D、人工增雨、防雹作业中使用的主要是碘化银人工冰核,每次的用量很少,不会造成污染.
解答:A、甲醛是一种重要的有机原料,是有味有毒的气体,主要用于人工合成黏结剂,所以在装饰材料、涂料、化纤地毯中都含有甲醛,用于室内装修时会引起室内空气的污染,故A正确;
B、明矾净水作用是利用铝离子水解形成的胶体具有较大的表面积能吸附悬浮在水中的杂质,起到净水作用,不是氢氧化铝沉淀的作用,故B错误;
C、猪肉盖上蓝色的检验印,是食用色素,这种专用液由亮蓝(常用作药品和食品的着色剂)、酒精、甘油、维生素C、蒸馏水等混合搅拌溶解而成.食品蓝检验标记专用液是符合食品卫生要求的可食用原料,不会对人体造成任何危害,故C正确;
D、碘化银中的银离子是重金属,但碘化银用量极小,分散在很大的区域里面,单位面积的含量微乎其微.由于用量很小,从短期和长期来看,不会对环境和人体造成伤害,故D正确;
故选B.
点评:化学来源于生活又服务于生活,但是在使用化学物质时要合理的使用,防止对环境造成污染、对人体造成伤害,例如本题中的甲醛,在装修完之后要注意室内通风,防止室内空气的污染而对人体造成伤害.
本题难度:一般
3、填空题 (1)P4(白磷,s)+5O2(g)══ P4O10(s)? ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s)? ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为?,
相同状况下,红磷的稳定性比白磷?(填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做?极,发生?反应;
电解池中,与电源正极相连的极是?极,发生?反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
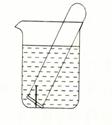
①若试管内液面上升,发生?腐蚀,正极反应式为?。
②若试管内液面下降,发生?腐蚀,正极反应式为?。
参考答案:(1)P4(白磷,s)=4P(红磷,s) ΔH=-29.2 kJ/mol(2分)
强?(1分)?(2)负?、 氧化 、 阳 、?氧化?(各1分)
(3)吸氧?(1分)? O2+4e-+2H2O=4OH-?(2分)
析氢?(1分)? 2H++2e-=H2 ↑?(2分)
本题解析:(1)根据盖斯定律可知,①-②×4即得到P4(白磷,s)=4P(红磷,s),所以该反应的反应热ΔH=-2983.2kJ/mol+738.5kJ/mol×4=-29.2 kJ/mol。这说明白磷的总能量高于红磷的总能量,所以红磷稳定性强于白磷的。
(2)在原电池中,通常较活泼的金属做负极,失去电子,发生氧化反应;在电池中,与电源正极相连的极是阳极,失去电子,发生氧化反应。
(3)①若试管内液面上升,说明试管内压强减小,氧气被消耗,因此是吸氧腐蚀,正极反应式是O2+4e-+2H2O=4OH-。
②若试管内液面下降,说明试管内压强增大,有气体生成,因此是析氢腐蚀,正极反应式是2H++2e-=H2↑。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对基础基础知识的了解掌握情况,以及灵活运用基础知识解决实际问题的能力。该题的关键是掌握好电化学原理以及有关的应用,有利于培养学生的逻辑思维能力和应试能力。
本题难度:一般
4、选择题 已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是? ( )
A.N2(g)+3H2(g) 2NH3(g) ΔH=-93 kJ·mol-1
2NH3(g) ΔH=-93 kJ·mol-1
B.N2(g)+3H2(g)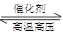 2NH3(g) ΔH=+1471 kJ·mol-1
2NH3(g) ΔH=+1471 kJ·mol-1
C.N2(g)+3H2(g)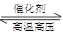 2NH3(g) ΔH=+93 kJ·mol-1
2NH3(g) ΔH=+93 kJ·mol-1
D.N2(g)+3H2(g)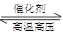 2NH3(g) ΔH=-1471 kJ·mol-1
2NH3(g) ΔH=-1471 kJ·mol-1
参考答案:A
本题解析:根据反应热和键能的关系可得,ΔH=945 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=-93 kJ·mol-1。
本题难度:一般
5、填空题 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s)+H2O(g) ?CO(g)+H2(g)。
?CO(g)+H2(g)。
而C(g)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+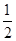 ?O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
?O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
③CO(g)+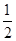 ?O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
?O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
请你根据上述信息回答下列问题:
(1)煤是一种成分复杂的混合物,其中除含碳、氢元素外,还含有氧、硫、氮、砷、硒等元素。所以固体煤燃烧会导致大气污染,写出煤燃烧产生的两种污染: ,将石灰石粉与煤粉混合,可以有效地减少煤燃烧过程中的二氧化硫污染,写出该反应的化学方程式:____________________
(2)根据已知热化学方程式写出由煤制备水煤气的热化学方程式:____________________________。
(3)下面是甲、乙两位同学对上述热化学方程式及煤燃烧的理解。
甲同学:1 mol CO与1 mol H2燃烧放出的热量之和大于1 mol固体炭燃烧放出的热量,所以煤燃烧时加入少量水,可以使煤燃烧放出更多的热量。
乙同学:根据下面的物质与能量循环,将煤炭转化为水煤气,再燃烧放出的热量与直接燃烧煤炭放出的热量相同,而将煤炭转化为水煤气将会增加消耗,故煤炭转化为水煤气得不偿失。
C(s)+H2O(g)+O2(g) CO2(g)+H2O(g)
CO2(g)+H2O(g)
 ?
?
CO(g)+O2(g)+H2(g) CO(g)+H2O(g)+
CO(g)+H2O(g)+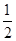 ?O2(g)
?O2(g)
请你评价两位同学的理解:
①甲同学的说法 (答“正确”或“不正确”),原因是______________________________________。
②乙同学的说法 (答“正确”或“不正确”),原因是_____________________________________。
参考答案:(1)酸雨(或答“二氧化硫污染大气”)、含砷粉尘污染、氮氧化物污染(答出两种即可)
2SO2+2CaCO3+O2=2CaSO4+2CO2
(2)C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131.5 kJ·mol-1
(3)①不正确 加入水,水汽化需要吸收能量
②不正确 尽管将煤炭转化为水煤气再燃烧放出的热量与直接燃烧煤炭放出的热量相同,但水煤气与氧气接触面积大,反应速率快,燃烧充分,能量利用率高,污染小
本题解析:煤在燃烧时产生的SO2、NyOx及含砷的化合物等均会污染大气。工业上用CaCO3固硫,发生的反应为:2CaCO3+2SO2+O2=2CaSO4+2CO2。
本题难度:一般