1、选择题 合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4?(g)+ 2H2O?(g)  CO2(g)+4H2?(g)
CO2(g)+4H2?(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键
| C—H
| O—H
| C=O
| H—H
|
吸收热量(kJ/mol)
| 414
| 464
| 803
| 436
|
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是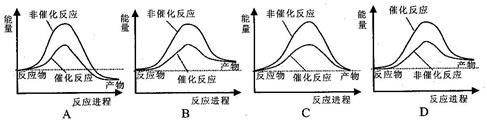
2、选择题 化学与生活密切相关,结合学过的化学知识,判断下列结论不正确的是
A.室内空气污染之一主要是来自绝缘材料、化纤、油漆等装饰材料释放的甲醛气体
B.用明矾净水是因为Al3+水解生成的Al(OH)3沉淀具有表面积大、吸附性强的特征
C.经卫生防疫部门检验合格的猪肉往往盖上蓝色的检验印章,此印色部分也可以食用
D.人工增雨作业、防雹作业时火箭弹中发射的碘化银,不会造成环境重金属污染
3、填空题 (1)P4(白磷,s)+5O2(g)══ P4O10(s)? ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s)? ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为?,
相同状况下,红磷的稳定性比白磷?(填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做?极,发生?反应;
电解池中,与电源正极相连的极是?极,发生?反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
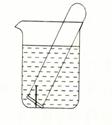
①若试管内液面上升,发生?腐蚀,正极反应式为?。
②若试管内液面下降,发生?腐蚀,正极反应式为?。
4、选择题 已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是? ( )
A.N2(g)+3H2(g) 2NH3(g) ΔH=-93 kJ·mol-1
2NH3(g) ΔH=-93 kJ·mol-1
B.N2(g)+3H2(g)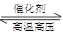 2NH3(g) ΔH=+1471 kJ·mol-1
2NH3(g) ΔH=+1471 kJ·mol-1
C.N2(g)+3H2(g)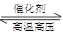 2NH3(g) ΔH=+93 kJ·mol-1
2NH3(g) ΔH=+93 kJ·mol-1
D.N2(g)+3H2(g)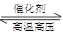 2NH3(g) ΔH=-1471 kJ·mol-1
2NH3(g) ΔH=-1471 kJ·mol-1
5、填空题 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s)+H2O(g) ?CO(g)+H2(g)。
?CO(g)+H2(g)。
而C(g)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+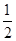 ?O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
?O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
③CO(g)+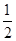 ?O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
?O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
请你根据上述信息回答下列问题:
(1)煤是一种成分复杂的混合物,其中除含碳、氢元素外,还含有氧、硫、氮、砷、硒等元素。所以固体煤燃烧会导致大气污染,写出煤燃烧产生的两种污染: ,将石灰石粉与煤粉混合,可以有效地减少煤燃烧过程中的二氧化硫污染,写出该反应的化学方程式:____________________
(2)根据已知热化学方程式写出由煤制备水煤气的热化学方程式:____________________________。
(3)下面是甲、乙两位同学对上述热化学方程式及煤燃烧的理解。
甲同学:1 mol CO与1 mol H2燃烧放出的热量之和大于1 mol固体炭燃烧放出的热量,所以煤燃烧时加入少量水,可以使煤燃烧放出更多的热量。
乙同学:根据下面的物质与能量循环,将煤炭转化为水煤气,再燃烧放出的热量与直接燃烧煤炭放出的热量相同,而将煤炭转化为水煤气将会增加消耗,故煤炭转化为水煤气得不偿失。
C(s)+H2O(g)+O2(g) CO2(g)+H2O(g)
CO2(g)+H2O(g)
 ?
?
CO(g)+O2(g)+H2(g) CO(g)+H2O(g)+
CO(g)+H2O(g)+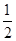 ?O2(g)
?O2(g)
请你评价两位同学的理解:
①甲同学的说法 (答“正确”或“不正确”),原因是______________________________________。
②乙同学的说法 (答“正确”或“不正确”),原因是_____________________________________。