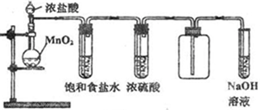
1、填空题 实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2
Cl2↑+MnCl2+2H2O
(1)该反应的离子方程式为?.
(2)广口瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是?.
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气直接排入大气中,会污染环境.实验室中可用?溶液来吸收有毒的氯气尾气.
(4)用浓盐酸80mL,其溶液密度为1.19g/cm3,溶质的质量分数为36.5%,跟MnO2充分反应,产生了5.6L(标准状况)的氯气.则浓盐酸的物质的量浓度为?;被氧化的HCl的物质的量为?.
参考答案:
本题解析:
本题难度:一般
2、填空题 实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
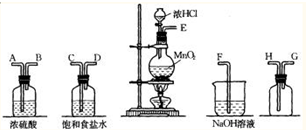
(1)连接上述仪器的正确顺序是(填各接口处的字母):______接______,______接______,______接______,______接______.
(2)在装置中:①饱和食盐水起的作用是______浓硫酸起的作用是______.
参考答案:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:E-C,D-A,B-H,G-F;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气.
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收水蒸气,干燥Cl2;
本题解析:
本题难度:简单
3、填空题 资料显示:“氨气可在纯氧中安静燃烧…某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.
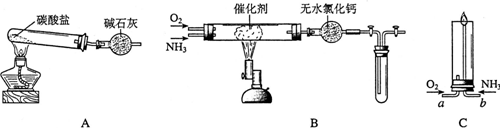
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是?;碱石灰的作用是?.
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式?;试管内气体变为红棕色,该反应的化学方程式是?.
②停止反应后,立即关闭B中两个活塞.一段时间后,将试管浸入冰水中.试管内气体颜色变浅,请结合化学方程式说明原因?.
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通人到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是?;其理由是?
②氨气燃烧的化学方程式是?.
参考答案:(1)碳酸盐加热分解能产生NH3,只有(NH4)2CO3或NH4HCO3,其分解产生的混合气体通过碱石灰后,CO2和H2O被吸收,可得到纯净的NH3.故答案为:(NH4)2CO3?或NH4HCO3;?吸收水和二氧化碳;
(2)①NH3与过量O2在催化剂、加热条件下发生反应:4NH3+5O2催化剂.△4NO+6H2O,通过无水CaCl2后,未反应完的NH3和生成的H2O被吸收,生成的NO在试管内被过量的O2氧化为红棕色的NO2气体,方程式为:2NO+O2═2NO2.
故答案为:4NH3+5O2?催化剂.△4NO+6H2O;2NO+O2═2NO2;
②将试管浸入冰水中,由于2NO2(g)
?N2O4(g)△H<0,正反应为放热反应,当温度降低时,平衡向正反应方向移动,部分红棕色的NO2转化为无色N2O4,故颜色变浅.故答案为:2NO2?

?N2O4 △H<0,降温平衡向正反应方向移动,颜色变浅;
(3)由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染.NH3在纯氧中燃烧的化学方程式为:4NH3+3O2?点燃?.?2N2+6H2O(O2置换N2).
故答案为:先通O2,后通NH3;若先通NH3,氨气在空气中不能燃烧,逸出造成环境污染;4NH3+3O2??点燃?.?2N2+6H2O.
本题解析:
本题难度:简单
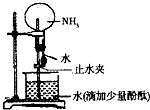
4、选择题 如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验