1、选择题 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O ?+O2+xOH-===Fe3O4+S4O
?+O2+xOH-===Fe3O4+S4O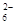 ?+2H2O,下列说法中,正确的是( )
?+2H2O,下列说法中,正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
参考答案:B
本题解析:由电荷守恒知x=4,该反应中O2作氧化剂,Fe2+、S2O 均作还原剂,每生成1mol Fe3O4,转移电子总数为4mol,3mol Fe2+参与反应有2mol Fe2+被氧化,被Fe2+还原的O2的物质的量为
均作还原剂,每生成1mol Fe3O4,转移电子总数为4mol,3mol Fe2+参与反应有2mol Fe2+被氧化,被Fe2+还原的O2的物质的量为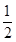 ?mol,故1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
?mol,故1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为 ?mol。
?mol。
本题难度:一般
2、选择题 LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
A.LiAlH4是共价化合物,LiH是离子化合物
B.生成等质量的氢气,反应①、②转移电子数之比为4?3
C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成
参考答案:C
本题解析:A项,LiAlH4由Li+、AlH4—构成,它是离子化合物,错误;B项,反应①中生成3 mol氢气时,转移6 mol电子,反应②中生成4 mol氢气时,转移4 mol电子,生成等量氢气时转移电子数之比为2?1,错误;C项,氢化锂具有强还原性,与水发生归中反应生成氢气,正确;D项,氢气所处温度和压强不确定,不一定是标准状况,所以无法计算铝的质量,错误。
点拨:本题考查化合物的分类、氧化还原反应原理及简单计算等,意在考查考生将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
本题难度:一般
3、选择题 运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P =3P2O5+5KC1。下列有关该反应的叙述中,正确的是
A.氯酸钾是还原剂
B.反应中消耗3molP时,转移电子的物质的量为15mol
C.KCl既是氧化产物,又是还原产物
D.发令时产生的白烟只是KC1固体颗粒
参考答案:B
本题解析:在反应5KC1O3+6P =3P2O5+5KC1中,P元素的化合价从0价升高到+5价,失去5个电子,因此P是还原剂,五氧化二磷是氧化产物。氯元素的化合价从+5价降低到-1价,得到6个电子,氯酸钾是氧化剂,氯化钾是还原产物。A、氯酸钾是氧化剂,A不正确;B、反应中消耗3molP时,转移电子的物质的量=3mo×5=15mol,B正确;C、氯化钾是还原产物,C不正确;D、反应中生成的五氧化二磷也是固体,因此发令时产生的白烟不只是KC1固体颗粒,D不正确,答案选B。
本题难度:一般
4、选择题 一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1 mol Cr2O72-反应所需PbO2的物质的量为
A.3.0 mol
B.1.5 mol
C.1.0 mol
D.0.75 mol
参考答案:A
本题解析:1 mol Cr2O72-得到6摩尔的电子,而因为PbO2到Pb2+化合价之差为2,所以需要.3.0 mol。
本题难度:一般
5、选择题 据悉,第16届中国广州亚运会在上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:KClO3+ P-- P2O5+ KCl(未配平),则下列有关叙述错误的是(?)
A.上述反应是放热反应
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.该反应氧化剂与还原剂物质的量之比为6:5
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
参考答案:C
本题解析:A、只有该反应为放热反应,才可满足实际需要,发出响声,正确
B、正确
C、氯的化合价由+5降至—1价,而磷的化合价由0价升至+5价,该反应氧化剂KClO3与还原剂P物质的量之比为5:6
D、磷的化合价由0价升至+5价,故消耗3molP时,转移电子的物质的量为15mol
选项C符合题意
本题难度:一般