1、简答题 I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是______.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10?10C+P4O10═P4+10CO
每生成1mol?P4时,就有______mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I-?2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a?mol?L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b?mol?L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是______mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol?L-1
KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1
Na2SO3溶液的体积/mL | H2O的体积
/mL | 实验
温度
/℃ | 溶液出现蓝色时所需时间/s
实验1
5
V1
35
25
实验2
5
5
40
25
实验3
5
5
V2
0
|
该实验的目的是______;表中V2=______mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(5)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是______.
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:______Ce3++______H2O2+______H2O═______Ce(OH)4↓+______.
参考答案:(1)P属于第15号元素,其原子的结构示意图为

,故答案为:

;
(2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4 mol=20 mol或C化合价由0价变成为+2价,电子转移为2×10 mol=20 mol,故答案为:20;
(3)I2溶液一部分与硫代硫酸钠反应,一部分与维生素C反应,n(Na2S2O3)=bV21000mol;
与其反应的碘单质为 bV22000mol,与维生素C反应的碘单质为 2aV1-bV22000mol,
即维生素C的物质的量是 2aV1-bV22000=aV1-0.5bV21000;
故答案为:2aV1-bV22000;
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:目的是探究该反应速率与亚硫酸钠浓度,反应温度的关系,V2=40?mL;
(5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可知NH4Cl的作用是分解出HCl气体,抑制CeCl3水解,
故答案为:分解出HCl气体,抑制CeCl3的水解;
(6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2;1;6;2;6H+.
本题解析:
本题难度:一般
2、填空题 高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应配平后的离子方程式____________________。
(2)不同条件下高锰酸钾可发生不同如下反应:
MnO4-+5e+8H+→Mn2++4H2O? MnO4-+3e+2H2O→MnO2+4OH-?MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与?有关。
(3)高锰酸钾可代替二氧化锰用来制取Cl2,反应中氧化剂和还原剂物质的量之比为_____________。
(4)高锰酸钾溶液与硫化亚铁在酸性条件下发生如下反应:
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为?。
参考答案:(1)2MnO4-+5C2O4 2-+16H+═10CO2↑+2Mn2++8H2O
(2)溶液的酸碱性
(3)1:5
(4)0.1Na
本题解析:(1)CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,其中发生氧化反应的只有C2O42-→CO2,故能有C2O42-与MnO4- 发生反应,其反应方程式为2MnO4-+5C2O4 2-+16H+═10CO2↑+2Mn2++8H2O
(2)根据离子反应方程式可知,在酸碱条件不同下,高锰酸根反应后得到的产物不同。
(3)高锰酸钾用来制取Cl2,反应方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,化合价降低的Mn元素所在的反应物KMnO4是氧化剂。其中所有Mn元素化合价降低,10原子Cl化合价升高,故氧化剂和还原剂物质的量之比为1:5。
(4)10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O,反应物中固体为FeS,产物中固体为单质S,反应前后质量减少2.8g,根据差量法计算可知,共有0.05molFeS发生反应,故其中S元素为0.05mol。由S2-→S零价,转移电子数目为0.05mol×2=0.1mol电子。故发生电子转移的数目为.1Na。
本题难度:一般
3、选择题
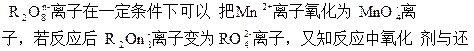
原剂的物质的量之比为5∶2。则n的值是?
A.1
B.2
C.3
D.4
参考答案:B
本题解析: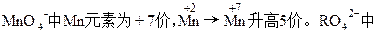
R元素为+6价。设R2O8n-中R元素的化合价为+x价关系式:5R2O8n-~2Mn2+
5×2×(x-6)=5×2
x=7
R2O8n-中,2×7+(-2)×8=-n
n=2
本题难度:一般
4、简答题 钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
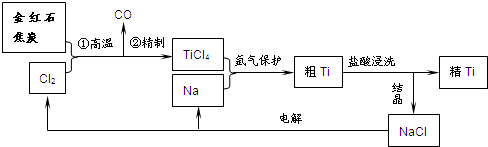
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/°C | 在水中 | ?在乙醚中
?TiCl4
?136
强烈水解
?易溶
?SiCl4
?58
?强烈水解
?易溶
?FeCl3
?303(升华)
水解
?易溶
|
从粗TiCl4中精制TiCl4的方法是______?A.用水溶解后,重结晶?B.蒸馏?C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4的化学方程式______.
(3)写出电解熔融NaCl的化学方程式______;阴极产物是______.
(4)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______.
(5)Ti可溶解在浓HF溶液中,请完成下列离子方程式.______Ti+______HF-______TiF62-+______+______H2↑
参考答案:(1)粗TiCl4中加热易气化,与固体混合物可用分馏的方法分离,由表中数据可知,TiCl4在水中强烈水解,易变质,且易溶于乙醚中,不能分离,只能用蒸馏的方法分离,
故答案为:B;
(2)由流程图可知,反应为TiO2、C和Cl2,生成物为TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2?高温?.?TiCl4+2CO,
故答案为:TiO2+2C+2Cl2?高温?.?TiCl4+2CO;
(3)电解氯化钠生成金属钠和氯气,方程式为2NaCl?(熔融)?通电?.?2Na+Cl2↑,在阴极发生还原反应生成钠,
故答案为:2NaCl?(熔融)?通电?.?2Na+Cl2↑;钠;
(4)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出,
故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应);
(5)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2,
则有1Ti+6HF=1TiF62-+2H++2H2↑,
故答案为:1;6;1;2;2.
本题解析:
本题难度:一般
5、选择题 某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知反应过程中发生如下变化:K2Cr2O7→CrCl3,则下列说法不正确的是?
A.由此反应可知氧化性K2Cr2O7>Cl2
B.氧化剂和还原剂的物质的量之比为1:6
C.当转移0.2mol电子时,生成的还原产物的物质的量为0.1mol
D.发生氧化还原反应的氯元素与参加反应的氯元素的比为3:7
参考答案:C
本题解析:根据物质的氧化性、还原性的强弱规律可知反应为:K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2+7H2O. A.由此反应可知氧化性K2Cr2O7>Cl2,正确;B.氧化剂和还原剂的物质的量之比为1:6,正确;C.由方程式可知:每转移6mol的电子,生成氧化产物3mol。当转移0.2mol电子时,生成的氧化产物的物质的量为0.1mol,错误;D.发生氧化还原 反应的氯元素与参加反应的氯元素的比为6:14=3:7,错误。
本题难度:一般