| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《原电池原理》高频考点特训(2017年练习版)(八)
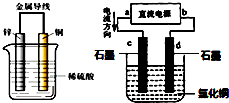 参考答案:A、锌、铜和稀硫酸组成的原电池中,锌作负极,铜作正极,正极上氢离子得电子生成氢气,电流从正极铜沿导线流向负极锌,故A错误; 本题解析: 本题难度:简单 4、选择题 有关右图装置中的叙述正确的是 ( ) 参考答案:B 本题解析:根据装置可知,该装置属于原电池。铁比Pb活泼,所以铁是负极,Pb是正极。由于电解质是氢氧化钠溶液,所以属于铁的吸氧腐蚀。反应过程中氢氧化钠并没有被消耗,大溶剂水参与反应,所以溶液的进行是增强的,因此正确的答案选B。 本题难度:一般 5、填空题 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2— 形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题 参考答案:(10分) 本题解析:Al和b电极构成原是电池,Al活泼易失电子发生氧化反应作负极,b作正极;c和d电极构成电解池,c作阳极d作阴极,(1)电极b是正极,电极反应式为HO2-+2e—+H2O=3OH—;(2)右池是电解池,电极c作阳极,电极反应式为CO(NH2)2-6 e—+8OH—=CO32—+N2+ 6H2O (3)由电子守恒,2.7gAl失电子0.3mol,生成氮气0.3mol/6=0.05mol,在标况下的体积为1.12L 。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学反应与.. | |