1、实验题 20.(10分)某厂以重晶石(有效成分是BaSO4)为主要原料制取Ba(OH)2·8H2O晶体的示意图如下:

已知:i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) ΔH1=+226.2 kJ/mol
C(s)+CO2(g)=2CO(g) ΔH2=+172.5kJ/mol
ii.某些物质的溶解度(g/100g)简表
| 10℃
| 20℃
| 40℃
| 60℃
| 80℃
|
Ba(OH)2·8H2O
| 2.48
| 3.89
| 8.22
| 20.9
| 101
|
NaOH
| 98.0
| 109
| 129
| 174
| 314
|
NaCl
| 35.8
| 35.9
| 36.4
| 37.1
| 38.0
|
BaCl2
| 33.5
| 35.8
| 40.8
| 46.2
| 52.5
|
回答下列问题:
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=____kJ/mol。
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2·8H2O。
途径1:

①得到固体1的离子方程式是______。
②固体2与水反应的化学方程式是______。
途径2:
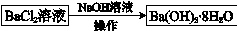
途径2中的“操作”是加热浓缩,冷却结晶,过滤。依据上述溶解度简表分析,过滤时的最佳温度是______;能从混合液中得到Ba(OH)2·8H2O晶体的原因是______。
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2·8H2O晶体和CuS的浊液,反应化学方程式是______。将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2·8H2O晶体。上述操作中趁热过滤的原因是______。
2、简答题 CH4?是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ?mol-1.它可以作为燃料电池的燃料.
(1)写出甲烷燃烧的热化学方程式:______;
(2)已知H2(g)和C(s)的燃烧热分别是285.8KJ?mol-1、393.5KJ?mol-1;则反应C(s)+2H2(g)=CH4(g)的反应热△H=______;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池.该电池的负极反应式为:______;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500ml滴有酚酞的NaCl溶液,装置如图所示:
①请写出电解过程中阴极附近观察到的现象:______.
②到燃料电池消耗2.8L?O2(标准状况下)时,计算此时NaCl溶液的pH=______(假设溶液的体积不变,气体全部从溶液中逸出).在Y极通过的电子的物质的量为:______.
③电解之后,要使溶液恢复原状,应该向溶液中加入物质______(填名称).溶液中Cl-流向______极(填“X”或“Y”).
3、选择题 2008年北京奥运会火炬采用了只含碳、氢两种元素的丙烷做燃料,燃烧后只生成CO2和H2O,对环境无污染,体现了绿色奥运的精神.已知1g丙烷完成燃烧生成CO2气体和液态水,放出50.405kJ热量,则下列热化学方程式正确的是( ? )
A.C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-50.405kJ/mol
B.C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=+2217.82kJ/mol
C.C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=+50.405kJ/mol
D.C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2217.82kJ/mol
4、选择题 已知:(1)Zn(s)+1/2O2(g) = ZnO(s);ΔH =-348.3 kJ/mol;(2)2Ag(s)+1/2O2(g) = Ag2O(s);ΔH =-31.0 kJ/mol,则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的?ΔH等于( )
A.-317.3 kJ/mol
B.-379.3 kJ/mol
C.-332.8 kJ/mol
D.317.3 kJ/mol