1、选择题 已知:H2(g)+F2(g)→2HF(g)+270kJ,下列说法正确的是
[? ]
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量
参考答案:C
本题解析:
本题难度:简单
2、填空题 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知N2(g)+2O2(g)="===2" NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________________。
参考答案:(1)N2H4(l)+2 H2O2 (l) ="==" N2(g)+ 4 H2O (g) △H=" -" 641.625 kJ·mol-1
(2)2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g);△H=" -" 1135.7kJ·mol-1
本题解析:(1)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)
本题难度:一般
3、选择题 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1?mol产物时的能量变化).下列叙述正确的是

[? ]
A.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)==2PCl3(g)?;ΔH=-306?kJ/mol
B.PCl5分解生成PCl3和Cl2的热化学方程式为:PCl5(g)==PCl3(g)+Cl2(g);ΔH=-93?kJ/mol
C.P和Cl2分两步反应生成1?mol?PCl3的ΔH大于306?kJ/mol ?
D.P和Cl2分两步反应生成1?mol?PCl5的ΔH等于399?kJ/mol
参考答案:D
本题解析:
本题难度:一般
4、填空题 (19分)我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油。甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)  CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
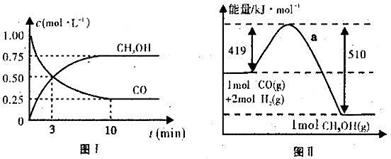
请根据图示回答下列问题:
(1)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_______________。
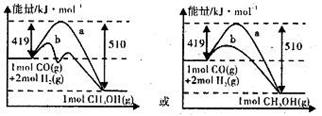
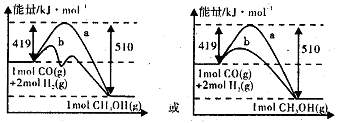
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b。
(3)写出该反应的热化学方程式 。
(4)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(5)恒容条件下,下列措施中能使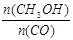 增大的有 。
增大的有 。
A.升高温度 B.充人He气
C.再充入1molCO和2molH2 D.使用催化剂
(6)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡 (填“逆向移动”、“正向移动”、“不移动”)
(7)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容器
| 甲
| 乙
| 丙
|
投料量
| 1mol CO 、2mol H2
| 1molCH3OH
| 2molCH3OH
|
CH3OH的浓度(mol·L-1)
| c1
| c2
| c3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 吸收Q3kJ
|
体系压强(Pa)
| P1
| P2
| P3
|
反应物转化率
| α1
| α2
| α3
|
则下列关系正确的是
A.c1= c2 B.Q3= 2Q2 C.2 P1<P3
D.α1+α2=1 E.2α2=α3
E.2α2=α3
F.该反应若生成1molCH3OH放出的热量为(Q1+ Q2)kJ
(8)若在一体积可变的密闭容器中充入1mol CO、2mol H2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是
参考答案:(1)0.075mol/(L·min)
(2)
(3)CO(g) + 2H2(g)  CH3OH(g);△H= -91kJ·mol-1
CH3OH(g);△H= -91kJ·mol-1
(4) 减小
减小
(5)C
(6)逆向移动 (7)ADF
(8)正 反应前后气体总质量不变,同温同压下达到平衡时气体密度增大,即气体体积缩小,平衡正向移动
本题解析:(1)v(CO)=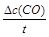 =
=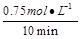 =0.075mol/(L·min)。
=0.075mol/(L·min)。
(2)使用催化剂降低反应活化能,但△H不变。图象为:
(3)反应物能量比生成物能量高,反应为放热反应,热化学方程式为:
CO(g)+2H2(g)=CH3OH(g) △H= -91kJ·mol-1
(4)反应平衡常数表达式为 ,反应为放热反应,升高温度,平衡向左移动,K减小。
,反应为放热反应,升高温度,平衡向左移动,K减小。
(5)升高温度,平衡左移, 减小;充入He气和使用催化剂,平衡不移动,
减小;充入He气和使用催化剂,平衡不移动, 不变;再充入1molCO和2molH2等效于增大压强,平衡向右移动,
不变;再充入1molCO和2molH2等效于增大压强,平衡向右移动, 增大。
增大。
(6)恒温,K不变,保持CO浓度不变,扩大容器体积,浓度商Q>K,平衡向逆反应方向移动。
(7)甲和乙完全等效,c1=c2, 1+
1+ 2=1,Q1+Q2=91,p1=p2;
2=1,Q1+Q2=91,p1=p2;
乙与丙比较:c3>2c2,Q3<2Q2,p3<2p2, 3<
3< 2。
2。
(8)体系中全是气体,质量守恒,达到平衡时气体密度增大,所以体积缩小,反应向正方向进行。
考点:化学反应速率 热化学方程式 勒沙特列原理 化学平衡常数 等效平衡
点评:本题综合性较强,尤其是(7)等效平衡的判断难度较大。
本题难度:困难
5、填空题 氮是大气中含量十分丰富的一种元素,氮及其化合物在生产、生活中有着重要应用。氮氧 化物会导致环境污染,生产中需要严格治理有关污染。请回答下列问题。
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ的热量,生成1 mol N三N键放出942 kJ的热量,请写出N4转变为N2的反应的热化学方程式:___。
(2)已知NH3在氧气中燃烧可生成N2和水。据报道,NH3可直接用作车用碱性燃料电池,写出该电池的负极反应式:____。
(3)已知:温度低于21.15 ℃时,NO2几乎全部转变为N2O4。工业上可用N2O4与水反应来提高硝酸的产率。N2O4与氧气在冷水中生成硝酸的化学方程式为___。
(4)工业上可用Na2CO3溶液吸收NO2,该反应的化学方程式为2NO2+Na2CO3=NaNO2+___ +____。
(5)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50 mol/L、 c(N2O4) =0.125 mol/L。则该条件下2NO2(g) 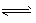 N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。
N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。
参考答案:(1)N4(g)=2N2(g) △H=-882kJ.mol -1
(2)2NH3 +6OH--6e-=N2+6H2O
(3)2N2O4+O2+2H2O=4HNO3
(4) NaNO3 ;CO2
(5)0.5;50%
本题解析:
本题难度:一般