1、填空题 (4分) 已知:
①P4(S,白磷)+5O2(g)= P4O10(S)△H = —2983.2kJ?mol-1
②P(S,红磷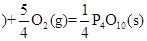 △H = —738.5kJ?mol-1
△H = —738.5kJ?mol-1
(1)写出白磷转化为红磷的热化学方程式: 。
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A ~ D] 。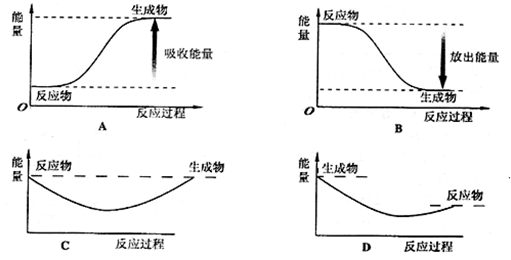
2、填空题 (3分)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。 已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g);△H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1= 。
3、填空题 (1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:

①a、b、c分别代表什么意义?
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH
反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
H2(g) H2(l) ΔH=-0.92 kJ·mol-1
H2(l) ΔH=-0.92 kJ·mol-1
O2(g) O2(l) ΔH=-6.84 kJ·mol-1
O2(l) ΔH=-6.84 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
4、填空题 日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
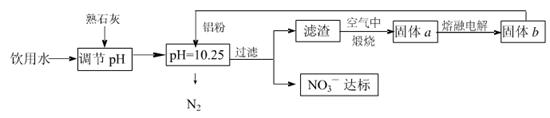
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。
(4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
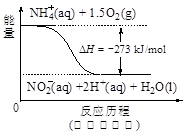
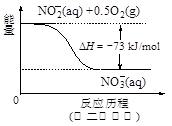
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
(5)固体a熔融电解时阴极反应式为
5、填空题 (14分)二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
①由表中数据判断ΔH 0 (填“>”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变
C.混合气体的相对分子质量不变 D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图。请回答下列问题:
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图。请回答下列问题:
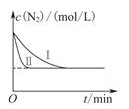
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。
