1、填空题 (共8分) XeO3是一种不稳定的物质,具有强氧化性。
2(1)配平反应的离子方程式:
XeO3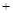 Mn
Mn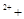 H2O → MnO
H2O → MnO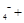 Xe↑
Xe↑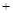 H
H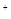
(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入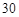 mL 0.1mol·L
mL 0.1mol·L Mn
Mn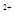 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。
此时转移电子 mol。
将反应后的溶液稀释至90mL,所得溶液的pH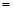 。
。
2、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,震荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是l,不用填写): ___口+___口+___口→__HIO3+__口
(2)整个过程中的还原剂是______。
(3)把KI换成KBr,则CCl4层变为____色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_________。
?(4)加碘盐中含碘量为20 mg-50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2_____L(标准状况,保留2位小数)。
3、选择题 将0.39g锌粉加入到20.0 mL的0.200 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物可能是
A.M+
B.M2+
C.M3+
D.MO42-
4、填空题 某化学兴趣小组用以下装置探究SO2的某些化学性质。
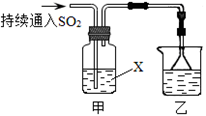
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
5、计算题 金属锡的纯度可以通过下述方法测定:将样品溶于盐酸Sn+2HCl=SnCl2+H2↑,再加过量的FeCl3溶液。发生如下反应:SnCl2+2FeCl3=SnCl4+2FeCl2,最后可用一定浓度的K2Cr2O7溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有金属锡试样0.613g,经上述反应后,共用去0.1mol/L的K2Cr2O7的硫酸溶液16.0mL。⑴ 写出K2Cr2O7氧化Fe2+的离子方程式,并配平;⑵ 试样中锡的质量分数(假定杂质不参加反应)。