1、选择题 下列说法正确的是
A.常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
B.铅蓄电池在放电过程中,负极质量增加,正极质量减少
C.其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积
D.常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4)
参考答案:A
本题解析:A、根据△G=△H-T·△S可知,反应的自发性与焓变、熵变均有关系。常温下,反应2A (s)+B (g)=2C (g)+D (g)是熵值增加的反应,若不能自发进行,则该反应△H一定大于0,A正确;B、铅蓄电池在放电过程中,负极和正极均有硫酸铅生成,电极均是质量增加的,B不正确;C、水的离子积常数只与温度有关系,因此其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,但水的离子积不变,C不正确;D、碳酸钡是过量的,所以沉淀中一定含有碳酸钡,与盐酸反应放出CO2气体,不能证明碳酸钡的溶度积常数小于硫酸钡的溶度积常数,D不正确,答案选A。
本题难度:一般
2、选择题 铜锌原电池(如图)工作时,下列叙述正确的是( )

A.铜片上的电极反应为:
B.正极上发生还原反应
C.在外电路中,电子流动方向为:从铜片经导线流向锌片
D.盐桥中的K+移向ZnSO4溶液
参考答案:B
本题解析:略
本题难度:简单
3、选择题 原电池能实现下列哪种能量形式的转化( )
A.化学能转化为电能
B.电能转化为化学能
C.化学能转化为热能
D.化学能转化为光能
参考答案:原电池是一种把化学能转化为电能的装置,原电池工作时,电池中发生氧化还原反应把化学能转化为电能,
故选:A.
本题解析:
本题难度:一般
4、选择题 对于锌-铜-稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5g?②锌片增重32.5g? ③铜片上析出1g H2? ④铜片上析出1mol H2.
A.①③
B.①④
C.②③
D.②④
参考答案:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为
Zn+H2SO4=ZnSO4+H2 ↑.
设当导线中有1mol电子通过时,理论上负极锌片溶解x,铜片上析出氢气y.
Zn+H2SO4=ZnSO4+H2 ↑? 转移电子
65g?2g? 2mol
x? ?y? 1mol
x=32.5g?
y=1g
故选A.
本题解析:
本题难度:简单
5、填空题 化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
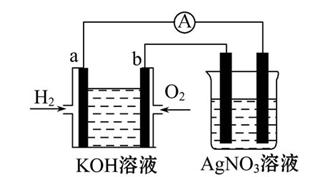
(1)对于氢氧燃料电池,下列表达不正确的是?。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变