| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《原电池原理》考点特训(2017年冲刺版)(八)
参考答案:B 本题解析:根据原电池原理,作为负极的金属活动性比正极的金属活动性强。电子流动方向是由负极流向正极,电流方向与电子流动方向相反,因此可依次作出如下判断,活动性:①a>b;②c>d;③a>c;④d>b,综上所述,金属活动性:a>c>d>b。 本题难度:一般 3、选择题 X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出(使用惰性电极);又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为 参考答案:A 本题解析: 本题难度:一般 4、选择题 用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 |
参考答案:C
本题解析:用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池,可知Cu做负极、Ag作正极,反应原理:Cu+2AgNO3="2Ag+" Cu(NO3)2与铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同,故④叙述正确;外电路中电子由Cu流向Ag,电流由Ag流向Cu,故①叙述错误;正极反应:Ag++e-=Ag,故②正确;实验过程中取出盐桥,则不再是闭合回路,原电池停止工作,故③叙述错误;故本题选C。
考点:电化学原电池原理。
本题难度:一般
5、选择题 将等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加少量组成原电池的条件CuS04溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系如图所示,其中正确的是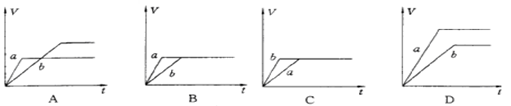
参考答案:A
本题解析:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生:Fe+Cu2+=Fe2++Cu,形成原电池,反应速率增大,但生成的氢气少.
解答:解:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生的反应为:
Fe+Cu2+=Fe2++Cu,铜-铁-稀硫酸形成原电池,反应速率增大,反应用时少于b,但生成的氢气少也少于b,图象应为A.
故选A.
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学平衡》.. | |