1、选择题 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是(?)
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol·L-1
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
参考答案:B
本题解析:设Cu、Cu2O的物质的量分别x、y
则

A项正确;C项,2x+2y=3n(NO) n(NO)=0.2 mol,C项正确;D项,剩余HNO3为1.0 mol·L-1×1.0 L-0.4 mol×2=0.2 mol,正确;n(HNO3)=1.0 mol·L-1×1.0 L+0.2 mol=1.2 mol
c(HNO3)= =2.4 mol·L-1。
=2.4 mol·L-1。
本题难度:简单
2、选择题 下列叙述正确的是( )
A.将磁性氧化铁放入稀HNO3中发生如下反应:3Fe3O4+28HNO3﹦9Fe(NO3)3+NO↑+14H2O?反应中每还原0.2?mol氧化剂,就有0.6?mol电子转移
B.KMnO4、O2、H2O2、H2SO4(稀)、H2O、K2SO4、MnSO4存在于同一化学反应中,配平后硫酸的化学计量数为5
C.0.2mol?L-1CH3COONa溶液和0.1mol?L-1HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-)
D.凡含有食品添加剂的食物对人体健康均有害,不可食用
参考答案:A、反应3Fe3O4+28HNO3﹦9Fe(NO3)3+NO↑+14H2O?中,只有氮元素的化合价降低,由+5价降低为+2价,被还原,每还原0.2mol氧化剂HNO3生成NO0.2mol,所以转移电子0.2mol×(5-2)=0.6mol,故A正确;
B、根据元素化合价变化及元素守恒可知反应物为KMnO4、H2O2、H2SO4(稀)生成物为MnSO4、K2SO4、O2、H2O,KMnO4是氧化剂,锰元素化合价由+7价降低为+2价,H2O2是还原剂,氧元素由-价升高为0价,根据电子转移守恒,可知KMnO4与H2O2的物质的量之比为2:5,反应方程式为2KMnO4+5H2O2+3H2SO4═2MnSO4+K2SO4+5O2+8H2O,配平后硫酸的化学计量数为3,故B错误;
C、0.2mol?L-1CH3COONa溶液和0.1mol?L-1HCl溶液等体积混合后,发生反应生成CH3COOH和NaCl,CH3COONa有剩余,混合溶液相当于CH3COOH、NaCl、CH3COONa三者等浓度的混合溶液,电离大于水解,溶液呈酸性,c(H+)>c(OH-),c(CH3COO-)>c(Cl-),溶液中钠离子浓度最大,氯离子远大于氢离子浓度,所以离子浓度为c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故C错误;
D、食品添加剂能改善食品品质和色、香、味以及为防腐、保鲜和加工工艺的需要,在合理范围对人体健康无害,故D错误.
故选A.
本题解析:
本题难度:一般
3、选择题 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是
A.NaN3中氮元素的化合价为—3
B.氧化剂和还原剂是同一物质
C.反应过程中若转移1mol电子,则产生2.24L气体(标准状况)
D.被氧化的氮原子与生成的氮气分子个数之比为15:8
参考答案:D
本题解析:A项NaN3中含N3-,错误;B项NaN3为还原剂,KNO3为氧化剂,错误;C项由方程式可知转移10mol电子,产生16mol气体,现若转移1mol电子,产生1.6mol气体,错误。
本题难度:一般
4、填空题 高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式:?。
(2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为?。
(3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为?。
参考答案:(1)2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
(2)1∶5 (3)0.15NA(或9.03×1022)
本题解析:(1)MnO4-→Mn2+为还原过程,故与之对应的应为氧化过程C2O42-→CO2。根据得失电子守恒将方程式配平即可。(2)酸性条件下,KMnO4溶液的氧化性较强,其与浓盐酸反应时,被还原为Mn2+,根据电子守恒可知氧化剂和还原剂(HCl)物质的量之比为1∶5。(3)根据方程式可得关系式:
10FeS ~ 10S ~ Δm ~ e-
880 g? 320 g? 560 g? 30 mol
2.8 g? n(e-)
n(e-)=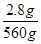 ×30 mol=0.15 mol。
×30 mol=0.15 mol。
本题难度:一般
5、选择题 在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于(? )
A.0.16mol/L
B.0.02mol/L
C.0.20mol/L
D.0.25mol?L?1
参考答案:C
本题解析:H2SO3的还原性大于HBr,,所以Cl2先氧化H2SO3设H2SO3的物质的量为n,可得方程:n+1/4n=0.025mol,得n=0.02mol,浓度为0.20mol?L?1。
本题难度:一般