1、填空题 电镀厂镀铜废水中含有CN-和Cr2O72-,需要处理达标后才能排放。该厂拟定下列流程进行废水处理:
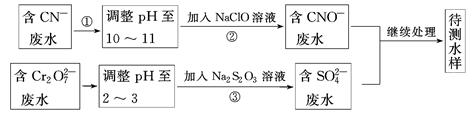
回答下列问题:
(1)上述处理废水流程中主要使用的方法是________。
(2)②中反应后无气体放出,该反应的离子方程式为______________________________
__________________________________。
(3)步骤③中,每处理0.4 mol Cr2O72-时转移电子2.4 mol,该反应的离子方程式为________________________________________________________________________。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:
________________________________________________________________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O,将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列结论正确的是________。
A.x=0.5,a=8
B.x=0.5,a=10
C.x=1.5,a=8
D.x=1.5,a=10
参考答案:(1)氧化还原法
(2)CN-+ClO-=CNO-+Cl-
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq),因为Ksp(CuS)<Ksp[Cu(OH)2]
(5)D
本题解析:(1)废水的处理方法有沉淀法、吸咐法、中和法、混凝法、氧化还原法等。由上述流程图中反应②和反应③加入的试剂并对比反应前后的物质,可以发现两个反应均为氧化还原反应,故上述处理废水的主要方法是氧化还原法。(2)反应物为CN-和NaClO,生成物有CNO-,即CN-生成CNO-,相当于C由+2价升高至+4价,那么根据氧化还原反应得失电子守恒可知,ClO-在反应中元素化合价降低,题目提示无气体生成,故其中的+1价Cl转化为Cl-,因此离子方程式为CN-+ClO-=CNO-+Cl-。(3)由反应物S2O32-转化为生成物SO42-可知,Cr2O72-被还原,其中Cr元素化合价降低,设Cr2O72-被还原后Cr的化合价为+n,则有关系:1∶2×(6-n)=0.4∶2.4,所以n=3,即Cr2O72-被还原为Cr3+,因此该反应的离子方程式为3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O。(4)先生成Cu(OH)2沉淀,加入Na2S后,Cu(OH)2沉淀转化为CuS沉淀。这是因为Cu(OH)2的溶解度比CuS的溶解度大,或者说Cu(OH)2的溶度积大于CuS的溶度积,难溶的电解质转化为更难溶的电解质。(5)生成铁氧磁体的物质的量为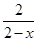 ?mol,根据得失电子守恒有
?mol,根据得失电子守恒有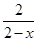 ×x=6,得x=1.5,a=
×x=6,得x=1.5,a=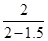 ×(1+1.5)=10。
×(1+1.5)=10。
本题难度:一般
2、选择题 Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是(? )
A.Na2O2在上述反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能产生胶体净水
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
参考答案:A
本题解析:6份的Na2O2中只有1份中的氧失去电子变成氧气,另外5份中的氧得到电子变成-2价的氧,A项错;2 mol Fe2+转化为+6价的铁时,转移8 mol电子,再加上生成1 mol O2时Na2O2失去的2 mol电子,反应中共转移10 mol电子,D项对。
本题难度:一般
3、选择题 在KClO3+6HCl=KCl+3Cl2+3H2O反应中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为(? )
A.6:1
B.5:1
C.1:3
D.1:5
参考答案:B
本题解析:
【错解分析】由于反应过程中KClO3得到6个电子被还原,而HCl失去一个电子被氧化,因此,氧化产物和还原产物的物质的量之比为6:1,选择A;或者由于反应过程中KClO3得到电子还原为KCl(还原产物),而HCl失去电子被氧化Cl2(氧化产物),根据化学方程式得到氧化产物和还原产物的物质的量之比为1:3,选择C
【正解】明确反应的实质,解题过程中同种元素发生氧化还原反应时化合价变化要遵循“只靠近不交叉”的原则即“价态归中”。由于该反应属于归中反应,反应机理为:KClO3中Cl得到5个电子转化为Cl2(被还原)同样的HCl中的Cl失去一个电子转化为Cl2(被氧化),反应中氧化产物和还原产物均为Cl2,且氧化产物和还原产物的物质的量之比等于氧化剂得电子数和还原剂失去电子数之比,即5:1.
本题难度:一般
4、简答题 硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是_______,滤液1后两步操作的目是:______.
(2)完成加漂粉精反应的离子方程式:
______Fe(OH)2+____________+____________→______Fe(OH)3+______Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是______.
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
______,______(用文字叙述)
(5)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥.
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于______.
参考答案:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分,滤液1中混有Fe3+和Fe2+,调节PH,加入漂白精的目的是将Fe2+氧化为Fe3+,生成Fe(OH)3沉淀除去,故答案为:增大反应物接触面积或增大反应速率或使反应更充分;除去含铁杂质;
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,
故答案为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH)(或其它合理答案);
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,故答案为:Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH(任写两个即可);
(5))“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,故答案为:蒸发浓缩、冷却结晶;
(6)设碳酸锌的质量为m,利用关系式法计算:
? ZnCO3----ZnO
?125? 81
?m? m2
ZnCO3 的质量为125m281
ZnCO3 的质量分数为125m281m1,故答案为:125m281m1.
本题解析:
本题难度:一般
5、填空题 (13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)?△H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
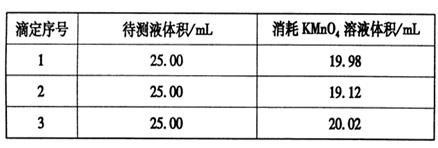
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:

①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
参考答案:(1)Fe2O3+2Al Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
(3)①酸式?②溶液恰好变浅紫红色,且半分钟内不褪色 ③0.080 00 mol·L-1
(4)①3.5?②SO2
本题解析:(1)氧化铁与铝反应发生的是铝热反应,方程式为Fe2O3+2Al Al2O3+2Fe;
Al2O3+2Fe;
(2)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)?△H=+468.2 kJ·mol-1、②C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。则根据盖斯定律可知②×3-①即得到反应4Fe(s)+3O2 (g)=2Fe2O3(s),所以该反应的反应热△H=-393.5 kJ/mol×3-468.2 kJ/mol=-1648.7kJ/mol;
(3)①酸性KMnO4溶液具有强氧化性和酸性,应盛放在酸式滴定管中;
②由于酸性高锰酸钾溶液显紫红色,所以判断达到滴定终点的现象是溶液恰好变浅紫红色,且半分钟内不褪色;
③根据表中数据可知,第二次实验中消耗高锰酸钾溶液的体积与其余二次相差较大,舍去不用,因此消耗高锰酸钾溶液的体积平均值为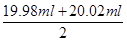 =20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为
=20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为 ×5=0.080 00 mol·L-1。
×5=0.080 00 mol·L-1。
(4)①已知ZnFe2O4与H2反应的物质的量之比为2:1,则根据原子守恒可知,反应中还生成1分子水,所以ZnFe2Ox中x=(4×2-1)÷2=3.5;
②在ZnFe2Ox中铁元素的化合价是+2.5价,而反应后变为+3价,化合价升高,失去电子,做还原剂,因此氧化剂是二氧化硫。
本题难度:困难