1、填空题 (6分)某反应池中,发生“生物硝化过程”,利用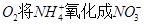 ,如果不考虑反应过程中硝化细菌的增殖,其净反应如下式所示:
,如果不考虑反应过程中硝化细菌的增殖,其净反应如下式所示:

(1)完成上述反应的离子方程式并配平,将系数填入方框中(系数是1也要填)。
(2)将铵态氮中的1mg氮转化成硝酸根中的氮,需氧气?mg。(精确0.01)
(3)取100mL完全反应后溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中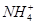 的浓度为?
的浓度为?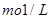 。(假设反应前后溶液的体积不变)
。(假设反应前后溶液的体积不变)
参考答案:(1)1,2;1,2,1?(2)4.57? (3) 2
本题解析:此题综合考查了氧化还原方程式的配平及化学平衡的移动问题。在离子方程式的配平中既要遵守得失电子守恒,还要注意方程式两边电荷守恒。
(1)根据方程式可知,氮元素的化合价从-3价升高到+5价,失去8个电子。氧元素的化合价从0价降低到-2价,得到2个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是1,2;1,2,1。
(2)根据配平后的方程式可知,N~2O2,所以需要氧气是64mg÷14=4.57mg。
(3)19.2g铜粉的物质的量是0.3mol,失去0.6mol电子,所以生成0.2molNO,则氮原子总的物质的量是0.2mol,所以NH4+的浓度是0.2mol÷0.1L=2mol/L。
本题难度:一般
2、选择题 在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为(? )
A.1/5 mol
B.2/5 mol
C.3/5mol
D.11/5 mol
参考答案:A
本题解析:根据方程式可知,硫酸铜中铜的化合价从+2价降低到+1价,得到1个电子。P元素的化合价从0价升高到+5价,失去5个电子,所以1mol硫酸铜能氧化单质P的物质的量是1/5 mol,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重考查学生分析问题,以及灵活解决问题的能力。该题的关键是明确P既是氧化剂,也是还原剂,因此解题的方法是根据电子的得失守恒进行,而不应该根据化学方程式中的系数。
本题难度:一般
3、填空题 (1)在较浓强碱溶液中紫色(MnO4-)转变为绿色(MnO42-),请完成下列反应方程式:
4MnO4-+___OH-→4MnO42-+____+____;
以下是MnO42-转变为MnO4-的两种方法,请完成相应的方程式。
(2)通入CO2降低强碱的浓度:3MnO42-+____ H2O→____MnO4-+____MnO2+____ OH-
(3)电解。
①阳极反应式:____________;阴极反应式:________________。
②实验中发现,若电解时间过长,溶液颜色又转变成绿色。为什么?______________。
参考答案:(1)4MnO4-+4OH-=4MnO42-+O2↑+2H2O
(2)3MnO42-+2H2O=2MnO4-+1MnO2+4OH-
(3)①MnO42--e-=MnO4-; MnO42-+2e-+2H2O=MnO2+4OH-;②电解时间过长,生成的NaOH浓度过高,会发生反应:4MnO4-+4OH-=4MnO42-+O2↑+2H2O
本题解析:
本题难度:一般
4、选择题 将1.95g锌粉加入到200mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是(?)
A.M
B.M2+
C.M3+
D.MO2+
参考答案:B
本题解析:锌在反应中失去2个电子,1.95g锌的物质的量是1.95g÷65g/mol=0.03mol,失去0.06mol电子。氧化剂的物质的量是0.2L×0.100mol/L=0.02mol,则根据电子得失守恒可知,氧化剂在反应中得到电子的个数是0.06mol÷0.02mol=3个电子,所以其还原产物中M的化合价是+5-3=+2价,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,针对性强,注重答题的灵活性。根据电子的得失守恒是解题的关键。
本题难度:一般
5、选择题 一定体积0.01 mol·L-1的稀硝酸恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01 mol·L-1 NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸的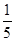 ,则样品中铁、铝的物质的量之比为( )。
,则样品中铁、铝的物质的量之比为( )。
A.2∶3
B.1∶3
C.1∶4
D.5∶3
参考答案:C
本题解析:设样品中铁和铝的物质的量分别为x和y,根据Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O、Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,反应中消耗HNO3的物质的量为4x+4y;而2Al+2NaOH+2H2O=2Na[Al(OH)4]+3H2↑中消耗NaOH的物质的量为y,即 =
=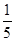 ,解得x∶y=1∶4。
,解得x∶y=1∶4。
本题难度:一般