1、选择题 以下说法正确的是
[? ]
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素间只能形成共价键
D.金属元素与非金属元素的原子间只形成离子键
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( ? )
A.6和8
B.19和16
C.12和17
D.10和8
参考答案:C
本题解析:
本题难度:简单
3、选择题 在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.CaC2+2H2O→Ca(OH)2+HC≡CH↑
B.2Na2O+2H2O=4NaOH
C.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
D.2NaOH+Cl2=NaCl+NaClO+H2O
参考答案:A
本题解析:
本题难度:简单
4、选择题 X、Y、Z三种元素,已知X+和Y-两种离子具有相同的电子层结构,Z元素原子核内质子数比Y元素原子核内质子数少9个,Y-被氧化可生成YZ3-离子.下列说法正确的是( )
A.离子半径X+>Y-
B.X、Y、Z均属于短周期元素
C.X、Y、Z三种元素组成的物质至少有三种
D.Y属于第VA族元素
参考答案:已知Z元素原子核内质子数比Y元素原子核内质子数少9个,Y-被氧化可生成YZ3-离子,Y有+5、+7价,则Y为Cl,Z的质子数为17-9=8,所以Z为O;再由X+和Y-两种离子具有相同的电子层结构,离子的电子数相同,则X的质子数为17+1+1=19,所以X为K,
A.具有相同电子排布的离子,原子序数大的离子半径小,K的原子序数大,则离子半径X+<Y-,故A错误;
B.K为第四周期元素,不属于短周期元素,故B错误;
C.X、Y、Z三种元素组成的物质有KClO、KClO4、KClO3等,故C正确;
D.Y为Cl,属于ⅤⅡA族元素,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是( )
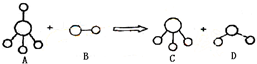
A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
参考答案:结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D,A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10,A为5原子离子,则A为NH4+,B为2原子离子,故B为OH-,则C为NH3,D为H2O,
A.NH3与H2O反应生成NH3?H2O,故A错误;
B.A为NH4+离子,不是分子,故B错误;
C.D为H2O,由于水分子之间存在氢键,沸点高于H2S,故C错误;
D.氯化铵为强酸弱碱盐,NH4+离子水解,溶液呈酸性,故D正确;
故选D.
本题解析:
本题难度:简单