1、选择题 X、Y、Z、M 代表四种金属元素。金属X 和Z 用导线连接放入稀硫酸中时,X 溶解,Z 极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y 先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为(?)
A.X>Z>Y>M ?B.X>Y>Z>M
C.M>Z>X>Y ? D.X>Z>M>Y
参考答案:A
本题解析:依据金属的活泼性相对强弱的判断可知。由金属X 和Z 用导线连接放入稀硫酸中时,X 溶解,Z 极上有氢气放出知:X为电源的负极,则X>Z;再由电解Y2+和Z2+共存的溶液时,Y 先析出可知:Z>Y;又由M2+的氧化性强于Y2+可知:Y>M。
本题难度:简单
2、选择题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
A.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ
B.c(Fe2+)︰c(Cu2+) = 2︰1
C.c(Fe2+)︰c(Fe 3+) = 3︰1
D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L
参考答案:C
本题解析:这是Fe3+和Cu反应后的混合溶液根据2Fe3+ +Cu ===2Fe2+ +Cu2+的反应式,废液中Fe2+和Cu2+的浓度比必为2:1,生成8.61g AgCl沉淀,10mL溶液中有0.06molCl-;又已知10mL溶液可反应掉0.256g=0.004mol的Cu,可知10mL溶液中Fe3+=0.008mol,则这,10mL溶液中含有0.008molFeCl3,0.012molFe2+,0.06molCu2+可知答案C是错误的. 3+和金属单质的反应
本题难度:一般
3、选择题 欲除去FeCl2溶液中少量的FeCl3,可行的办法( )
A.滴入KSCN
B.通入氯气
C.加入铁粉
D.加入铜粉
参考答案:C
本题解析:
本题难度:简单
4、简答题 查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
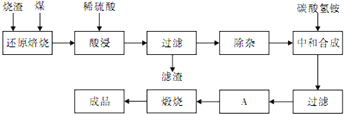
(1)焙烧时产生的主要有害气体是______.
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:______;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用______滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)=______.
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:______(用离子方程式表示).
(4)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2
开始沉淀的pH
3.10
2.01
7.11
万全沉淀的pH
4.77
3.68
9.61
|
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于______,检验Fe3+已经除尽的试剂是______(除KSCN外).
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是______.
参考答案:(1)硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),依据流程分析,加入碳还原会和二氧化硅反应生成硅和一氧化碳,硫铁矿燃烧会生成二氧化硫,生成的污染性气体为一氧化碳和二氧化硫,
故答案为:CO、SO2;
(2)依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷 守恒,电子守恒,原子守恒配平书写离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,滤液呈酸性需要用酸性滴定管取用,依据离子方程式计算得到滤液中亚铁离子物质的量,
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
1 5
0.10mol/L×0.012.04l n(Fe2+)
n(Fe2+)=0.00602mol
得到亚铁离子的浓度为0.00602mol0.02L=0.0301mol/L,
故答案为:酸式,0.0301mol/L;
(3)在空气中“酸浸”时间过长,溶液中Fe2+含量将下降的原因是亚铁离子在酸性溶液中被氧气氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(4)除去Fe3+和Al3+,依据图表中沉淀所需PH分析,溶液PH小于7.11时,亚铁离子不沉淀,铁离子和铝离子完全沉淀,检验铁离子除KSCN外,可以加入苯酚出现紫色证明铁离子的存在,
故答案为:7.11,苯酚;
(5)将溶液中Fe2+转变为碳酸亚铁沉淀,防止混入杂质,需要对沉淀继续洗涤干燥,
故答案为:洗涤或洗涤、干燥;
本题解析:
本题难度:一般
5、实验题 某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Fe的熔点、沸点数据如下

(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金.你认为他的解释是否合理?________(填“合理”或“不合理”).
(2)请你根据已有知识找出一种验证产物中有Fe的最简单的方法:______________________________________________________________.
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝.请填写下列表格:

参考答案:(1)合理
(2)用磁铁吸引,若能吸附,说明有铁生成
(3)取少量样品放入试管,加入NaOH溶液,若有气泡产生,说明该熔融物中有铝;2Al+2NaOH+2H2O===2NaAlO2+3H2↑
本题解析:
本题难度:一般