1、简答题 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1?将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2?向处理过的铁屑中加入过量的3mol?L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3?向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有______(填仪器编号)
①铁架台?②燃烧匙?③锥形瓶?④广口瓶?⑤研钵?⑥玻璃棒?⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是______;
(3)在步骤3中,“一系列操作”依次为______、______和过滤;
(4)本实验制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+常用的试剂是______,可以观察到得现象是______.
2、选择题 下列各组溶液,不加任何试剂(可加热)就可以区别的是()
A.Na2S、Na2SO3、AgNO3、NaCl、NaOH
B.HCHO、CuSO4、NaOH、FeCl2、FeSO4
C.Br2、CH3CHO、CH3COOH、Ag(NH3)2Cl、NaHCO3
D.KAl(SO4)2、NaHSO4、Al2(SO4)3、KCl、MgCl2
3、简答题 试简述在FeSO4溶液中加入NaOH溶液时的反应现象,并写出有关反应的化学方程式.
4、填空题 (12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为?▲ ?(填编号);
a.过量铁屑和稀硫酸?b.过量稀硫酸和铁屑?c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
烧杯编号
| ①
| ②
| ③
|
加入试剂
| 铁粉0.1g
| 铁粉0.1g,0.1mol/LH2SO43mL
| 0.1mol/LH2SO43mL
|
红色出现时间(天)
| 1天
| 4天左右
| 8天以上
|
?
⑶在烧杯②中加入2种试剂后,即可观察到的现象为?▲ ?;
⑷通过比较上述3组实验,可以得出的结论为?▲ ?;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①?试用一个离子方程式表示上述反应过程中的变化?▲ ?;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因?▲ ?。
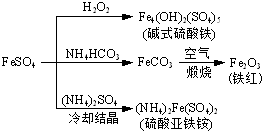
5、选择题 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( ? )
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大