1、填空题 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
元?素
| 性?质
|
A
| 一种核素的原子核内不含中子
|
B
| 原子核外电子有6种不同运动状态
|
C
| 最高价氧化物的水化物与其氢化物可发生非氧化还原反应
|
D
| 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线
|
E
| 在地壳中的含量位居第三
|
F
| 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍
|
G
| 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨
|
?
根据以上信息,回答下列问题:
(1)画出元素C的基态原子核外电子排布图:____;D、E、F三种元素的第一电离能大小顺序为:____(用元素符号表示)。
(2)化合物BA2D2蒸气293 K时,理论测算密度为1.9 g·L-1,实际密度为2.5 g·L-1的原因是___。
(3)FD2中F原子的杂化类型为______;分子空间构型为______;FD2易溶于水的原因可能是:_____(填入序号)。
①FD2与水极性相同?②FD2可以与水反应?
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:______。
(5)D、E形成的一种化合物硬度仅次于金刚石,主要用作高级研磨材料、制作手表的轴承,该物质晶体类型是______晶体。另一含有E的硫酸盐是一种常用净水剂,其水溶液呈_______(选填:“酸性”、 “中性”、“碱性”),原因是: ______(用离子方程式解释)。
(6)化合物M可用于制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾)。补充完整并配平该制备反应的化学方程式:□____+□KNO3+□____=□K2FeO4+□KNO2+□H2O
2、选择题 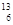 C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关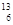 C的说法正确的是(?)
C的说法正确的是(?)
A.质子数为6
B.电子数为13
C.中子数为6
D.质量数为6
3、填空题 有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图??;C2粒子的符号:??;
(2)B、E两种元素形成化合物的电子式:??
(3)A、E两种元素形成的氢化物沸点较高的是:?(用化学式表示),
其原因是???。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
??
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式??。
4、选择题  是原子序数依次增大的短周期元素,
是原子序数依次增大的短周期元素, 是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
A.原子半径:X>Y>Q>W
B.工业上一般通过电解饱和食盐水得到X的单质和氢气、氯气
C.W和Z组成的化合物可造成酸雨
D.Q、X和W三种元素形成化合物的水溶液呈碱性
5、填空题 某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子量为 ;HXR的化学式为 。