1、填空题 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
元?素
| 性?质
|
A
| 一种核素的原子核内不含中子
|
B
| 原子核外电子有6种不同运动状态
|
C
| 最高价氧化物的水化物与其氢化物可发生非氧化还原反应
|
D
| 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线
|
E
| 在地壳中的含量位居第三
|
F
| 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍
|
G
| 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨
|
?
根据以上信息,回答下列问题:
(1)画出元素C的基态原子核外电子排布图:____;D、E、F三种元素的第一电离能大小顺序为:____(用元素符号表示)。
(2)化合物BA2D2蒸气293 K时,理论测算密度为1.9 g·L-1,实际密度为2.5 g·L-1的原因是___。
(3)FD2中F原子的杂化类型为______;分子空间构型为______;FD2易溶于水的原因可能是:_____(填入序号)。
①FD2与水极性相同?②FD2可以与水反应?
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:______。
(5)D、E形成的一种化合物硬度仅次于金刚石,主要用作高级研磨材料、制作手表的轴承,该物质晶体类型是______晶体。另一含有E的硫酸盐是一种常用净水剂,其水溶液呈_______(选填:“酸性”、 “中性”、“碱性”),原因是: ______(用离子方程式解释)。
(6)化合物M可用于制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾)。补充完整并配平该制备反应的化学方程式:□____+□KNO3+□____=□K2FeO4+□KNO2+□H2O
参考答案:(1) ; O>S>Al(2)甲酸形成分子间氢键(3)sp2杂化; V形; ①②(4)离子键、共价键(配位键);(5)原子; 酸性; Al3++3H2O
; O>S>Al(2)甲酸形成分子间氢键(3)sp2杂化; V形; ①②(4)离子键、共价键(配位键);(5)原子; 酸性; Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
(6)Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
本题解析:根据题意可推知个元素分别是A是H;B是C;C是N;D是O;E是Al;F是S;G是Fe. (1)画出元素N的基态原子核外电子排布图为 。元素的非金属性越强,其失去电子就越难,第一电离能就越大。所以D、E、F三种元素的第一电离能的大小顺序是:O>S>Al.(2)化合物CH2O2为甲酸。其蒸气在293K时理论测算密度为1.9g/L,而由于在甲酸分子之间存在着氢键,所以实际密度为2.5g/L.?(3)在SO2中S原子的杂化类型为sp2杂化;分子空间构型为V形;SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3.反应不断消耗SO2也使它不断的溶解。因此SO2易溶于水。(4)化合物NH5可写为NH4H的结构为含有离子键、共价键、配位键的离子化合物。(5)金刚石是原子晶体,硬度大,可制作手表的轴承,由于该物质性质与金刚石相似,所以该晶体类型也是原子晶体。Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性。水解的离子方程式为:Al3++3H2O
。元素的非金属性越强,其失去电子就越难,第一电离能就越大。所以D、E、F三种元素的第一电离能的大小顺序是:O>S>Al.(2)化合物CH2O2为甲酸。其蒸气在293K时理论测算密度为1.9g/L,而由于在甲酸分子之间存在着氢键,所以实际密度为2.5g/L.?(3)在SO2中S原子的杂化类型为sp2杂化;分子空间构型为V形;SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3.反应不断消耗SO2也使它不断的溶解。因此SO2易溶于水。(4)化合物NH5可写为NH4H的结构为含有离子键、共价键、配位键的离子化合物。(5)金刚石是原子晶体,硬度大,可制作手表的轴承,由于该物质性质与金刚石相似,所以该晶体类型也是原子晶体。Al2(SO4)3是强酸弱碱盐,水解使溶液显酸性。水解的离子方程式为:Al3++3H2O Al(OH)3+3H+;(6)Fe元素的可用作油漆颜料一种氧化物M为Fe2O3. 它可用作制备一种“绿色”环保高效净水剂K2FeO4。该反应为氧化还原反应。由于Fe的化合价Fe2O3--- K2FeO4从+3---+6,升高3×2,N的化合价KNO3—KNO2从+5—+3.降低2,根据化合价升高与降低的总数相等可知:Fe2O3系数为1,K2FeO4的系数为2,KNO3、KNO2的系数都是3,再结合反应前后各元素的原子个数相等,则由于生成物中含有H、K、O比反应物多可确定反应物还应该有KOH,其系数为4,。水的系数为2.所以该反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
Al(OH)3+3H+;(6)Fe元素的可用作油漆颜料一种氧化物M为Fe2O3. 它可用作制备一种“绿色”环保高效净水剂K2FeO4。该反应为氧化还原反应。由于Fe的化合价Fe2O3--- K2FeO4从+3---+6,升高3×2,N的化合价KNO3—KNO2从+5—+3.降低2,根据化合价升高与降低的总数相等可知:Fe2O3系数为1,K2FeO4的系数为2,KNO3、KNO2的系数都是3,再结合反应前后各元素的原子个数相等,则由于生成物中含有H、K、O比反应物多可确定反应物还应该有KOH,其系数为4,。水的系数为2.所以该反应的化学方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O。
本题难度:一般
2、选择题 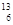 C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关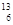 C的说法正确的是(?)
C的说法正确的是(?)
A.质子数为6
B.电子数为13
C.中子数为6
D.质量数为6
参考答案:A
本题解析:由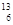 C可知其质子数是6,中子数是7,质量数是13,电子数是6,所以答案选A。
C可知其质子数是6,中子数是7,质量数是13,电子数是6,所以答案选A。
本题难度:简单
3、填空题 有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图??;C2粒子的符号:??;
(2)B、E两种元素形成化合物的电子式:??
(3)A、E两种元素形成的氢化物沸点较高的是:?(用化学式表示),
其原因是???。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
??
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式??。
参考答案:(1)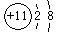 ?D或2H?(2)Na+[:Cl:]-(3)HF? HF分子之间存在氢键
?D或2H?(2)Na+[:Cl:]-(3)HF? HF分子之间存在氢键
(4)NH3+H+=NH4+?(5)8NH3+3Cl2=6NH4Cl+N2
本题解析:A是非金属性最强的元素,则A是F。E与A同族,因此E是Cl。金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu,所以B应该是钠。D的气态氢化物溶于水后显碱性,所以D是氮元素。C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3,这说明C元素应该是氢元素。
点评:该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、选择题  是原子序数依次增大的短周期元素,
是原子序数依次增大的短周期元素, 是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
A.原子半径:X>Y>Q>W
B.工业上一般通过电解饱和食盐水得到X的单质和氢气、氯气
C.W和Z组成的化合物可造成酸雨
D.Q、X和W三种元素形成化合物的水溶液呈碱性
参考答案:B
本题解析:
答案:B
Q―C、 W―O、 X―Na、 Y―Al 、Z―S ,A、正确,Na>Al>C>O;B、不正确,电解饱和食盐水得到NaOH、H2、Cl2;正确,SO2是形成酸雨的主要物质。D、正确,Na2CO3水解呈碱性。
本题难度:一般
5、填空题 某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子量为 ;HXR的化学式为 。
参考答案:34? H2S
本题解析:5.6L在标准状况下的物质的量是5.6L÷22.4L/mol=0.25mol,所以HXR的相对分子质量是8.5÷0.25=34。根据R元素的含量可知,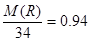 ,解得M(R)=32,则x=2,所以化学式为H2S。
,解得M(R)=32,则x=2,所以化学式为H2S。
本题难度:一般