1、简答题 已知A、B、C、D均为中学化学常见的物质,四者之间可以发生如下反应:
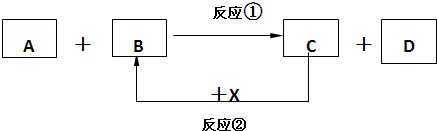
X是单质,由C+X→B仅仅表示转化过程中,B是转化的产物或产物之一,其它产物略去.试根据要求回答下列问题:
(1)若反应①在常温下能进行,反应②在一定条件下进行,且A、C为单质,B、D为化合物,请写出一组符合上述变化的物质:A为______;
反应为②的方程式:______;
(2)若B是单质,A、C、D均为化合物,反应条件不限,试写出一组符合上述变化的物质B为______;反应①的方程式:______;
(3)若C是单质,A、B、D均为化合物,反应条件不限,请写出一组符合上述变化的物质:
A为______;反应①的方程式:______;
(4)若A、B、C、D均为化合物,且常温下B为气态,A为非气态,则符合此关系的化学式X为______;反应①的方程式:______.
参考答案:(1)A、C为单质,B、D为化合物,反应为置换反应,反应①在常温下能进行,可为Na与水或Mg与盐酸的反应,A可为Na (Mg),反应为②的方程式为2H2+O2═2H2O(或:H2+Cl2═2HCl),
故答案为:Na?(Mg);?2H2+O2═2H2O(或:H2+Cl2═2HCl);
(2)若B是单质,A、C、D均为化合物,发生的为氧化还原反应,可为有机物的燃烧或氯化铁与铜的反应,则B为Cu (O2),
反应①的方程式为2FeCl3+Cu=CuCl2+2FeCl2(或:O2+2CH4=2CO2+2H2O),
故答案为:Cu (O2); 2FeCl3+Cu=CuCl2+2FeCl2(或:O2+2CH4=2CO2+2H2O);
(3)若C是单质,A、B、D均为化合物,可为过氧化钠与二氧化碳的反应等,则A为CO2,反应①的方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:CO2;2Na2O2+2CO2=2Na2CO3+O2;
(4)若A、B、C、D均为化合物,且常温下B为气态,A为非气态,可为NO2与水的反应,X为O2,反应①的方程式为3NO2+H2O=2HNO3+NO,
故答案为:O2;3NO2+H2O=2HNO3+NO.
本题解析:
本题难度:一般
2、填空题 (14分)甲、乙、丙、丁是四种短周期元素,乙原子有三个电 子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子
子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子 数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是?元素(填元素符号),甲的单质与水反应的化学方程式为?;
(2)乙是?元素(填元素符号),原子结构示意图为?;
(3)丙是?元素(填元素名称),最高价氧化物对应水化物的化学式是?;
(4)丁是?元素(填元素名称),甲与丁两种元素可组成的物 质有?、
质有?、
?。(填化学式)
参考答案:(14分)(1)Na(1分)? 2Na+2H2O=2NaOH+H2↑?(2分)
(2)Mg (1分)?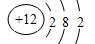 ?(2分)
?(2分)
(3)碳(1分) H2CO3?(2分)
(4)氧(1分) Na2O (2分),Na2O2(2分)
本题解析:略
本题难度:一般
3、填空题 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀
①A、B、C中含有的同一种常见金属元素为______.
②写出A、C的水溶液混合生成沉淀B的离子反应方程式为______.
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构.
①B的电子式为______.
②C能与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为______.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生.
①A中所含有的化学键是______.
②将过量X通入水玻璃溶液中,写出反应的离子方程式______.
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为______?g.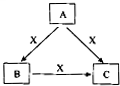
参考答案:(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠.
①A、B、C中含有的同一种常见金属元素为Al.
故答案为:Al.
②A的水溶液含有铝离子,C水溶液含有偏铝酸根,混合反应生成氢氧化铝沉淀,
反应离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3.
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3.
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气.
①B为三氯化磷,各原子都大8电子稳定结构,三氯化磷B的电子式为
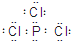
.
故答案为:
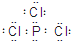
.
②C为五氯化磷,与水剧烈反应,生成磷酸和盐酸,反应的化学方程式为PCl5+4H2O=H3PO4+5HC1.
故答案为:PCl5+4H2O=H3PO4+5HC1.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳.
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是 离子键、共价键.
故答案为:离子键、共价键.
②x为二氧化碳,将过量二氧化碳通入水玻璃溶液中,生成硅酸与碳酸氢钠,反应的离子方程式为2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
故答案为:2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-.
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为 12×0.1L×0.5mol/L×106g/mol=2.65g.
故答案为:2.65.
本题解析:
本题难度:一般
4、填空题 (8分)下图中各物质均为中学化学中常见的物质,它们之间有如图转化关系。其中A、C均为金属单质;D的焰色反应呈黄色;C与水反应除了生成D,还能生成自然界最轻的气体;E是一种氢氧化物,它既能跟NaOH反应又能跟盐酸反应。(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)B是_________,E是_________。(填化学式)
(2)写出E转化为G的离子方程式?。
(3)写出C和水反应的化学方程式??。
参考答案:
本题解析:略
本题难度:一般
5、简答题 已知:甲、乙是单质,甲为黄绿色气体,乙蒸汽制得的电光源已大量应用于道路和广场的照明和航标灯;B、C、D、E、F五种化合物的焰色反应均为黄色;当D转化为C或E时,都生成能支持燃烧的无色气体单质;F是生活中常见的调味品.上述物质在一定条件下存在如图转化关系.(部分反应物或生成物已略去)
请回答下列问题:
(1)B物质的俗名是______;C物质的化学式为______;
(2)写出D生成E的离子反应方程式:______;
(3)写出B与E在溶液中反应的离子方程式:______;
(4)向C溶液中通入甲,可制得某种生产和生活中常用的漂白、消毒的物质,同时有B生成.该反应的化学方程式是:______.
(5)A与C溶液反应可生成B,其反应类型为______.

参考答案:甲、乙是单质,甲为黄绿色气体,应为Cl2,乙蒸汽制得的电光源已大量应用于道路和广场的照明和航标灯,应为Na,B、C、D、E、F五种化合物的焰色反应均为黄色,说明都含有Na元素;当D转化为C或E时,都生成能支持燃烧的无色气体单质,则该气体为O2,可知D应为Na2O2,C、E为NaOH或Na2CO3,由B加热生成C可知C应为Na2CO3,E为NaOH,B为NaHCO3,F是生活中常见的调味品,应为NaCl,A可生成NaHCO3或NaCl,且能生成Cl2,则A应为HCl,
(1)由以上分析可知B为NaHCO3,俗称小苏打,C为Na2CO3,故答案为:小苏打;Na2CO3;
(2)Na2O2生成NaOH的离子反应方程式2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(3)NaHCO3与NaOH在溶液中反应的离子方程式为HCO3-+OH-=CO32-+H2O,故答案为:HCO3-+OH-=CO32-+H2O;
(4)向Na2CO3溶液中通入Cl2,可制得某种生产和生活中常用的漂白、消毒的物质,应为NaClO,同时有NaHCO3生成.
该反应的化学方程式是2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3,
故答案为:2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3;
(5)HCl与Na2CO3溶液反应可生成NaHCO3,反应的方程式为Na2CO3+HCl=NaCl+NaHCO3,其反应类型为复分解反应,
故答案为:复分解反应.
本题解析:
本题难度:一般