1、填空题 分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I? SO2+2H2O+I2→H2SO4+2HI?
II? 2HI H2+I2
H2+I2
III? 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的 是_________?
a.反应III易在常温下进行? b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O?d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。
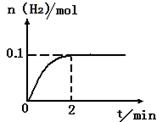
0—2min内的平均反应速率v(HI)= _________?。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数? b.HI的平衡浓度?
c.达到平衡的时间?d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
 ?
?
实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
2、选择题 将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)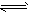 2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
2SO3(g),下列哪些情况能说明该可逆反应已达化学平衡状态的是
[? ]
A.每生成2mol SO2的同时,消耗2mol SO3
B.混合气体的质量不再变化
C.每生成2mol SO3的同时,消耗2mol SO3
D.每生成2mol SO3的同时,消耗1mol O2
3、选择题 某恒温密闭容器发生可逆反应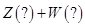

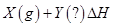 ,在
,在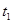 时刻反应达到平衡,在
时刻反应达到平衡,在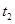 时刻缩小容器体积,
时刻缩小容器体积,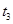 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
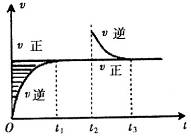
A.Z和W在该条件下至少有一个是为气态
B. 时间段与
时间段与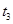 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则 时间段与
时间段与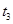 时刻后的X浓度不相等
时刻后的X浓度不相等
D.若该反应只在某温度 以上自发进行,则该反应的平衡常K随温度升高而增大
以上自发进行,则该反应的平衡常K随温度升高而增大
4、选择题 恒温、恒压下,1molA和nmolB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成
amolC,则下列说法中正确的是( )
A.物质A、B的转化率之比为1:2
B.起始时刻和达平衡后容器中混合气体密度相等
C.当v正(A)=2v逆(C)时,可断定反应达到平衡状态
D.相同条件下,若起始时放入3molA和3nmolB,则达平衡时生成3amolC
5、选择题 一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)?2B(g)+C(g),下列能说明反应已达平衡状态的是( )
A.混合气体的密度保持不变
B.容器内B、C的浓度之比为2:1
C.B的生成速率等于C的消耗速率
D.气体的体积分数保持不变