1、选择题 已知可逆反应:2SO2(g)+O2(g)?2SO3(g),下列关于此反应的说法中错误的是( )
A.加压可使该反应的反应速率变大
B.该反应中形成新化学键释放的能量大于断裂旧化学键所需要吸收的能量
C.将2molSO2和1molO2混合进行反应,反应完成时生成2molSO3
D.单位时间内生成2molSO3,同时生成1molO2说明该反应达到平衡状态
2、选择题 在容积固定的密闭容器中进行的可逆反应2NO2?N2O4达到平衡的标志是( )
A.反应停止了
B.容器内气体颜色不变
C.容器内气体总质量不变
D.容器内气体密度不变
3、选择题 在一定温度下,固定体积为2 L密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,n(SO2)随时间的变化如表:
2SO3(g) ΔH<0,n(SO2)随时间的变化如表:
时间/min
| 0
| 1
| 2
| 3
| 4
| 5
|
n(SO2)/mol
| 0.20
| 0.16
| 0.13
| 0.11
| 0.08
| 0.08
|
?
则下列说法正确的是( )
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
4、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
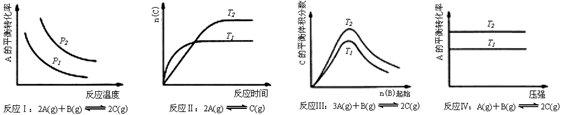
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,p2>p1
B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
5、填空题 为了减少温室气体排放,目前工业上采用CO2与H2在催化剂作用下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g) CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(CO2)(mol)
| 0.40
| 0.35
| 0.31
| 0.30
| 0.30
| 0.30
|
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是____________;
(2)平衡时CO2的转化率是____________。
(3)能说明反应已达平衡状态的是____________。
A.υ(H2)=3υ(CO2)?B.容器内压强保持不变?
C.υ逆(CO2)=υ正(CH3OH)?D.容器内密度保持不变
(4)一定能使该反应的反应速率增大的措施有 _________。
A.及时分离出产物
B.适当降低温度?
C.其他条件不变,增大CO2浓度