|
|
|
高考化学知识点总结《气体的净化、干燥、吸收与收集》高频考点特训(2017年练习版)(二)
2017-11-11 03:38:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、实验题 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_?;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
A.CaO
B.NaOH
C.CuCO3
D.Cu2(OH)2CO3 E. Fe2(SO4)3
| ④反应中加人少量FeSO4可加速铜的氧化,用离子方程式解释其原因?、
?
参考答案:(1)3:2;B。
(2)①坩埚;②3;③CD。-
④4Fe2++O2+4H+=4Fe3++2H2O;2Fe3++Cu=2Fe2++Cu2+;
本题解析:试题分析:(1)由题意书写化学方程式3Cu+2HNO3-+3H2SO4=3CuSO4+2NO↑+4H2O,因此H2SO4和HNO3物质的量之比为3:2; (2)①灼烧需要在坩埚中进行②假设c(Fe3+)=10-5mol·L-1由Ksp[Fe(OH)3]=10-38计算得c(OH-)=10-11mol·L-1,即pH值为11;③加入的物质需要能够消耗H+同时又不引入新的杂质;(4)(参照答案)。
本题难度:一般
2、实验题 下列装置为中学化学实验常用的气体制备装置
 ? ? ? ?
A? B? C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 ?。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 ?。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置?。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置?。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 ?。
写出氯气和氯化亚铁溶液反应的离子方程式:?。
③请写出氯气尾气处理的离子方程式 ??。
参考答案:(1)A(2)C(3)A (4)① A ②取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;Fe2++ Cl2=2 Fe3++2 Cl-?③Cl2+2OH-=Cl-+ClO-+ 2H2O
本题解析:(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置是固体和固体需要加热的,因此符合条件的是选项C。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(4)①根据反应的方程式可知Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2+2H2O,该反应是固体和液体之间不需要加热制备气体的,所以应该选择装置A。
②由于亚硫酸钡不溶于水,但能溶于水酸中。而硫酸钡不溶于水,也不溶于酸,所以证明亚硫酸钠已经被氧化实验方法是取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;氯气和氯化亚铁溶液反应的离子方程式是Fe2++ Cl2=2 Fe3++2 Cl-。
③氯气有毒,需要尾气处理,一般用氢氧化钠溶液吸收,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+ 2H2O。
点评:本题主要是考查学生对于装置的选取方法的应用及方程式的书写等知识,可以很好的考查学生对于知识的理解和应用能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的应试能力和学习效率。
本题难度:一般
3、实验题 (18分)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
实验
| 药品
| 制取气体
| 量气管中的液体
| ①
| Cu、稀HNO3
| ?
| H2O
| ②
| NaOH固体、浓氨水
| NH3
| ?
| ③
| Na2CO3固体、稀H2SO4
| CO2
| ?
| ④
| 镁铝合金、NaOH溶液(足量)
| H2
| H2O
|
?
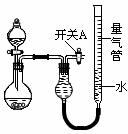
请回答下列问题:
(1)简述如何检查该装置的气密性: 。
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度。你认为是否可行?请简述原因。 。
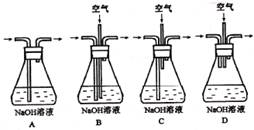
( 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有? 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?
、(4)实验③中,量气管中的液体最好是 。
A.H2O
B.CCl4
C.饱和Na2CO3溶液
D.饱和NaHCO3溶液
|
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②
,③视线与凹液面最低处相平。
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
编号
| 镁铝合金质量
| 量气管第一次读数
| 量气管第二次读数
|
①[
| 1.0g
| 10.0mL
| 346.3mL
|
②
| 1.0g
| 10.0mL
| 335.0mL
|
③
| 1.0g
| 10.0mL
| 345.7mL
|
根据上述
合理数据计算镁铝合金中铝的质量分数
。
参考答案:(1)关闭开关A和分液漏斗活塞,微热烧瓶,量气管左端液面升高,说明气密性好。
(2)不可行。因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准。
(3)ACDF
(4)D?
(5)②使量气管两端液面相平。
(6)27.0%。
本题解析:略
本题难度:一般
4、选择题 下列气体中,既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是
A.Cl2
B.SO2
C.H2
D.NH3
参考答案:C
本题解析:A.Cl2 B.SO2只可用浓硫酸干燥;D.NH3只可用固体氢氧化钠干燥;所以答案C正确。
本题难度:一般
5、选择题 括号内物质为杂质,下列除去杂质的做法不正确的是
A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液
B.乙烷(乙烯):用浓溴水洗气
C.乙醇(乙酸):用NaOH溶液中和后分液
D.乙醇(水):用生石灰吸水后蒸馏
参考答案:C
本题解析:略
本题难度:简单

 3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?
3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?





