1、计算题 某温度下,氢气和碘蒸气化合生成碘化氢的平衡常数是50,已知碘蒸气起始浓度为1mol·L-1,达平衡时有0.9mol·L-1碘化氢生成,求氢气的起始浓度和平衡浓度.
参考答案:氢气起始浓度为0.48mol·L-1,平衡浓度为0.03mol·L-1。?
本题解析:设H2的起始浓度为x,H2的平衡浓度为y
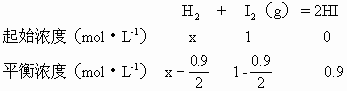
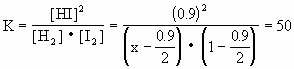
x=0.48mol·L-1
氢气的平衡浓度为y:

本题难度:一般
2、选择题 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)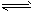 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
|

下列说法正确的是
[? ]
A.反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
参考答案:BC
本题解析:
本题难度:一般
3、选择题 难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2 (s)+2I2 (g)  TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)

下列说法正确的是(?)
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
参考答案:C
本题解析:温度可以影响化学平衡的移动,故A项错误。提纯过程中,TaS2是固体,对平衡无影响, B项错误。K= [TaI4]*[S2]/[I2]2,平衡常数与TaI4 和S2 的浓度乘积成正比,D项错误。
本题难度:一般
4、选择题 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 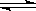 ?2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是(? )
?2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是(? )
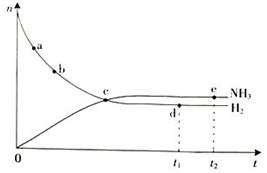
A.点e的正反应速率比点d的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)相同
D.在给定条件下,t1时刻NH3的含量达到最高
参考答案:CD
本题解析:略
本题难度:简单
5、简答题 将N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取出0.5mol该混合气体充入密闭容器里,使之发生反应并在一定条件下达到平衡,已知反应达平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:(1)反应前混合气体中N2和H2的体积比;
(2)达到平衡时混合气体中N2的物质的量;
(3)平衡时N2的转化率.
参考答案:(1)N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,则混合气体的平均相对分子质量=3.6×2=7.2,令0.5mol混合气体中N2和H2的物质的量分别为xmol、ymol,则:
本题解析:
本题难度:一般