1、填空题 (10分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
?1?根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
t/min
| X/mol
| Y/mol
| Z/mol
|
0
| 1.00
| 1.00
| 0.00
|
1
| 0.90
| 0.80
| 0.20
|
3
| 0.75
| 0.50
| 0.50
|
5
| 0.65
| 0.30
| 0.70
|
9
| 0.55
| 0.10
| 0.90
|
10
| 0.55
| 0.10
| 0.90
|
14
| 0.55
| 0.10
| 0.90
|
?2?体系中发生反应的化学方程式是_____________;
?3?列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
?4?该反应达到平衡时反应物X的转化率α等于________;
?5?如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件?温度、压强、催化剂?得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3?如上右图所示?则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。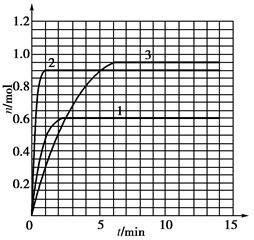
2、选择题 在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g) 4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是?(? )
4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是?(? )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=
3、选择题 已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)? ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
N2O4(g)? ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
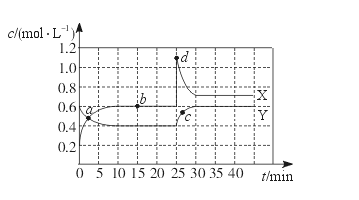
A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
4、选择题 已知H2(g)+I2(g) 2HI(g), 现有相同容积的体积可变的两个绝热容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,起始温度相同的条件下分别达到平衡。下列说法正确的是
2HI(g), 现有相同容积的体积可变的两个绝热容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,起始温度相同的条件下分别达到平衡。下列说法正确的是
A.平衡时甲、乙两容器体积相等
B.平衡时甲、乙两容器中c(H2)相等
C.平衡时甲、乙两容器中反应速率v(H2)相等
D.平衡时甲、乙两容器中气体总的物质的量相等
5、选择题 温度体积固定的容器中建立2NO2 N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情
N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为Φ,条件不变的情 况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:
况下,分别再充入NO2和再充入N2O4,平衡后会引起Φ的变化正确的是:
A.都引起Φ增大
B.充入NO2引起Φ增大,充入N2O4引起Φ减小
C.都引起Φ减小
D.充入NO2引起Φ减小,充入N2O4引起Φ增大