1、选择题 下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2 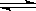 N2O4(正反应为放热反应)
N2O4(正反应为放热反应)
B.3O2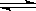 2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
C.H2(g)+I?2(g) 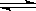 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D.NH4HCO3(s) 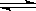 NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
参考答案:A
本题解析:略
本题难度:简单
2、选择题 将一定量的固体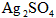 置于容积不变的密闭容器中(装有少量
置于容积不变的密闭容器中(装有少量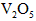 ),某温度下发生反应:
),某温度下发生反应:
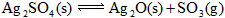 ,
,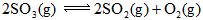 ,反应经过10min达到平衡,测得
,反应经过10min达到平衡,测得 ,
,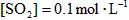 ,则下列叙述中不正确的是
,则下列叙述中不正确的是
[? ]
A.容器里气体的密度为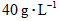
B.SO3的分解率为20%
C.在这10 min内的平均反应速率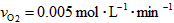
D.化学反应速率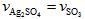
参考答案:D
本题解析:
本题难度:一般
3、选择题 反应CH3OH ( l )+ NH3( g ) = CH3NH2( g ) + H2O ( g )在某温度自发向右进行,若反应|ΔH|= 17kJ/mol,|ΔH—TΔS|= 17kJ/mol,对于该反应下列关系正确的是(?)
A.ΔH>0,ΔH–TΔS<0
B.ΔH <0,ΔH–TΔS>0
C.ΔH>0,ΔH–TΔS>0
D.ΔH<0,ΔH–TΔS<0
参考答案:A
本题解析:略
本题难度:简单
4、选择题 向Cr2(SO4)3水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着碱性增强,沉淀增多;但当[OH-1]大于0.1 mol·L-1时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。平衡关系如下:

向50mL0.05mol·L-1的Cr2(SO4)3溶液中,加入1.0mol·L-1NaOH溶液50mL,反应后观察到现象是
A.紫色?B.亮绿色? C有灰绿色沉淀 D.无法判断
参考答案:B
本题解析:根据方程式可知,增大OH-浓度,则平衡都向生成Cr(OH)3的方向进行,所以溶液显亮绿色,答案选B。
本题难度:简单
5、计算题 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
(1)x?(2) B的转化率
(3) 平衡时A的浓度?(4) 恒温达平衡时容器内的压强与开始时压强比
参考答案:(1)2?(2)20℅?(3) 0.75 mol/L?(4) 1:1
本题解析:(1)D的物质的量为n(D)=0.1mol?(L?min)-1×5min×4L=2mol,物质的量之比等于化学计量数之比,所以2:x=2mol:2 mol,解得x=2,
答:x的值是2;
(2)参加反应的B的物质的量n(B)=1/2n(C)=(1/2)×2mol=1mol,所以B的转化率为α=1mol÷5mol×100%=20%,
答:B的转化率为20%;
(3)△n(A)=(3/2)×2mol=3mol,n(A)平衡=n(A)起始-△n(A)=6mol-3mol=3mol,所以c(A)平衡= n(A)平衡÷V=3mol÷4L=0.75mol/L,
答:平衡时A的物质的量浓度为0.75mol/L;
(4)3A(g)+B(g) 2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1。
2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1。
答:恒温达平衡时容器内的压强与开始时压强比为1:1。
点评:本题考查化学平衡的计算,题目难度不大,注意对基础知识的理解、积累。
本题难度:一般