1、填空题 已知:2SO3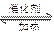 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A?B(大于;等于;小于);达平衡时SO3的转化率
A?B(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体,?容器的平衡将向?方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A?,B?
2、填空题 (13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡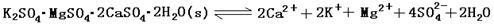
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
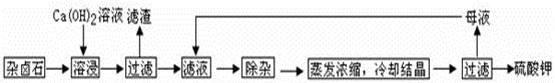
(1)滤渣主要成分有?和?以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:?。
(3)“除杂”环节中,先加入?溶液,经搅拌等操作后,过滤,再加入?溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,?
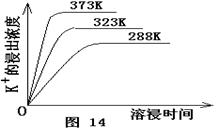
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5?,求此温度下该反应的平衡常数K?。
3、选择题 在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均相对分子质量减小的是
A.H2(g)+Br2(g) 2HBr(g)ΔH<0
2HBr(g)ΔH<0
B.N2(g)+3H2(g) 2NH3(g)ΔH<0
2NH3(g)ΔH<0
C.A(s) B(s)+ C(g)ΔH>0
B(s)+ C(g)ΔH>0
D.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
4、选择题 反应2A(g)+B(g)2C(g);△H>0。下列反应条件有利于生成C的是
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
5、选择题 下列有关化学反应速率的说法中,正确的是?
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率
C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,若升高温度,则吸热反应速率增大,放热反应速率减小