1、填空题 A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为?;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为?,C的元素符号为?;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为?,其基态原子的电子排布式为?。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为?,其E+ 的电子排布式为?。
参考答案:(1)N (2)C1 K? (3)Fe? ls22s22p63s23p63d64s2或[Ar]3d64s2
(4)Cu 1s22s22p63s23p63d10或[Ar]3d10
本题解析:(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N;(2)设元素B的核电荷数是a,C元素原子的核电荷数为b,因为阴离子B-与阳离子C+电子层结构都与氩相同相同,即核外电子数相同,所以a=18-1=17,b=18+1=19,则B的元素符号为Cl,C的元素符号为K;(3)D元素的正三价离子的3d亚层为半充满,即该正三价离子的所带的质子数为5+18+3=26,所以D的元素符号为Fe,其基态原子的电子排布式为:ls22s22p63s23p63d64s2或[Ar]3d64s2;(4)元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E为Cu,其E+ 的电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
点评:本题考查了原子结构与元素的性质,核外电子排布,属于对基础知识的考查,该题有利于考查学生对基础知识的掌握情况,该题难度不大。
本题难度:一般
2、实验题 某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
序号
| 实验方案
| 实验现象
|
①
| 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置
| 液体分为两层,下层呈_____色
|
②
| 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置
| 液体分为两层,下层呈_____色
|
?
(4)实验结论:_________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为________________、__________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________、______________。
参考答案:(3)①橙红 ②紫红
(4)同主族元素从上到下,元素原子的得电子能力逐渐减弱
(5)①Cl2+2Br-=Br2+2Cl- 2I-+Br2=2Br-+I2
②HF的稳定性比HCl的强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(其他合理答案也可)
本题解析:向溴化钠溶液中加入新制氯水,发生反应:Cl2+2Br-=Br2+2Cl-,证明氧化性:Cl2>Br2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈橙红色。向碘化钠溶液中加入新制溴水,发生反应:Br2+2I-=I2+2Br-,证明氧化性:Br2>I2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下,元素原子的得电子能力逐渐减弱。
本题难度:一般
3、选择题 在2010年4月召开的首届世界核安全峰会上,胡锦涛总书记倡导各成员国未来应安全、合理地开发利用核能。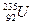 是
是 核反应堆的重要原料,下列说法中正确的是(? )
核反应堆的重要原料,下列说法中正确的是(? )
A.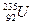 的中子数为235
的中子数为235
B.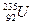 和
和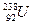 是同一种核素
是同一种核素
C.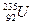 处在第六周期
处在第六周期
D.合理利用核能符合“低碳经济”要求
参考答案:D
本题解析:略
本题难度:简单
4、选择题 对元素周期表和元素周期律的发现有突出贡献的科学家是
A.拉瓦锡
B.阿伏加德罗
C.门捷列夫
D.道尔顿
参考答案:C
本题解析:发现元素周期表和元素周期律的是俄国化学家键门捷列夫,元素周期表和元素周期律的发现把化学元素及其化合物纳入一个统一的理论体系.
本题难度:简单
5、选择题 已知主族元素A和B的原子序数分别为a和b, 且原子半径为B > A , 则下列说法中正确的是
A.a 一定大于b
B.若A和B不在同一周期, 则a一定大于b
C.a 一定小于b
D.若A和B在同一周期, a一定大于b
参考答案:D
本题解析:略
本题难度:简单