1、填空题 [物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。

(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
参考答案:
(1) 3d84s2
(2) sp2、sp3
(3) NH3分子间存在氢键
(4) V型
(5) 24
(6) 3 mol或3NA
本题解析:(2)结构中碳原子均形成单键,为sp3杂化;(3)氨气分子间存在氢键,所以其溶沸点高;(4)该微粒为10电子微粒,三原子分子为水,氧原子为sp3杂化,空间结构为V型;(5)氨气中氮原子与Ni形成配位键,共6个,每个氨气分子中形成3个氮氢键,共有6+3×6=24mol;
(6)晶胞结构中原子数目:La? 8×1/8=1
H? 8×1/4+2×1/2=3
所以含1 mol La的合金可吸附H2的数目为3mol。
本题难度:一般
2、选择题 下列关于氢原子电子云图的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对电子运动无规律性的描述
参考答案:B
本题解析:A、小黑点不是电子本身,小黑点越密,表明概率密度越大,而不是电子数目大,A不正确;B、小黑点越密,表明概率密度越大,即黑点密度大,单位体积内电子出现的机会大,B正确;C、小黑点不是电子本身,小黑点是1s电子在原子核外出现的概率密度的形象化描述,因此不能用小黑点来表示电子绕核作高速圆周运动,C不正确;D、电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,而不是对电子运动无规律性的描述,D不正确,答案选B。
本题难度:简单
3、选择题 若aB2-与bAn+两种离子核外电子层结构相同,则a等于
A.b+n-2
B.b+n+2
C.b-n-2
D.b-n+2
参考答案:C
本题解析:
阳离子核外电子数=质子数-所带电荷数,所以bAn+的核外电子数为b-n;阴离子核外电子数=质子数+所带的电荷数,所以aB2-的核外电子数为a+2;aAn+与?bB2-两离子具有相同的电子层结构,说明二者核外电子数相同,所以b-n=a+2,即a=b-n-2,选C。
本题难度:一般
4、填空题 部分中学化学常见元素原子结构及性质如表所示:
序号
| 元素
| 结构及性质
|
①
| A
| A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5
|
②
| B
| B原子最外层电子数是内层电子总数的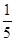
|
③
| C
| C是常见化肥的主要元素,单质常温下呈气态
|
④
| D
| D单质被誉为“信息革命的催化剂”,是常用的半导体材料
|
⑤
| E
| 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
|
⑥
| F
| F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
|
?
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱_____________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_________________________________________________________________。
参考答案:(1)第四周期、第Ⅷ族 (2)Mg3N2 离子
(3)分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(利用加其他催化剂或利用H2O2的漂白性和氧化性等,其他合理方法同样给分)
(4)4NH3+3O2 2N2+6H2O或N2H4+O2
2N2+6H2O或N2H4+O2 N2+2H2O
N2+2H2O
(5)取相同形状、相同大小的两种单质分别与相同浓度的稀盐酸反应,Mg的反应速率比Fe的反应速率快(其他合理答案同样给分)
本题解析:根据表格中提供的信息,可以推断A为Fe,B为Mg,C为N,D为Si,E为O,F为H。O2的氧化性强于N2,可以通过单质的置换反应验证。
本题难度:简单
5、选择题 具有下列最外层电子排布的基态原子,其相应的元素一定属于主族的是(?)
A.ns1
B.ns2
C.ns2np6
D.ns2np2
参考答案:D
本题解析:A、第一副族元素的基态原子最外层电子排布也为ns1,错误;B、氦、第二副族元素的基态原子最外层电子排布也为ns2,错误;C、除氦以外的零族元素的基态原子最外层电子排布为ns2np6,错误;? D、具有ns2np2排布的元素是p区的第四主族元素,正确,答案选D。
本题难度:一般