1、填空题 [物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。

(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
2、选择题 下列关于氢原子电子云图的说法正确的是
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对电子运动无规律性的描述
3、选择题 若aB2-与bAn+两种离子核外电子层结构相同,则a等于
A.b+n-2
B.b+n+2
C.b-n-2
D.b-n+2
4、填空题 部分中学化学常见元素原子结构及性质如表所示:
序号
| 元素
| 结构及性质
|
①
| A
| A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5
|
②
| B
| B原子最外层电子数是内层电子总数的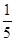
|
③
| C
| C是常见化肥的主要元素,单质常温下呈气态
|
④
| D
| D单质被誉为“信息革命的催化剂”,是常用的半导体材料
|
⑤
| E
| 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
|
⑥
| F
| F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
|
?
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱_____________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_________________________________________________________________。
5、选择题 具有下列最外层电子排布的基态原子,其相应的元素一定属于主族的是(?)
A.ns1
B.ns2
C.ns2np6
D.ns2np2