1、选择题 在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)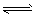 CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
[? ]
A.1.2mol
B.1.5mol
C.1.8mol
D.2.5mol
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列事实不能用勒夏特列原理解释的是?(?)
A.新制的氯水在光照条件下颜色变浅
B.开启啤酒瓶后,瓶中立刻泛起大量泡沫
C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
参考答案:C
本题解析:能用勒夏特列原理解释的是存在化学平衡的反应,且化学平衡要发生移动。KMnO4溶液加水稀释后溶液变浅不存在平衡,所以不能用勒夏特列原理解释。答案选C。
点评:勒夏特列原理是改变影响平衡移动的一个因素,平衡向减弱这种改变的方向移动。
本题难度:一般
3、选择题 在两个恒容容器中有平衡体系:A(g) 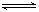 2B(g)和2C(g)
2B(g)和2C(g) 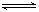 D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
D(g),X1和X2分别是A和C的转化率。在温度不变时,均增加相同的A和C的物质的量,下列判断正确的是
A.X1降低,X2增大
B.X1、X2均降低
C.X1增大,X2降低
D.X1、X2均增大
参考答案:A
本题解析:因为2个可逆反应中,反应物和生成物均是一种,因此不论加入多少A和C或B和D,均是相当于增大体系得压强,则第一个反应平衡向逆反应方向移动,而第2个反应则向正反应方向移动,所以转化量前者降低,或者增大,答案是A。
本题难度:一般
4、填空题 合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 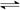 ?2NH3(g)?△H = -92 kJ·mol-1
?2NH3(g)?△H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
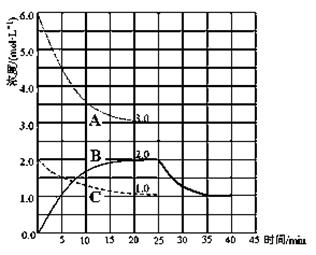
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是?(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是?。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ?(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将___?____(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ______?______。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ___?_____mol。
参考答案:(1)a c?(2)①C?②0.12 mol·L-1·min-1?③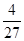 ?(或0.148、0.15); 减小
?(或0.148、0.15); 减小
(3)
说明:对曲线的曲率不做要求,但曲线弯的方向要考虑,这涉及到浓度对反应速率的影响问题。起点与终点要正确,达平衡的时间要一致。
(4)①60%?② 2
本题解析:(1)a.该反应随反应进行,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡, a正确;b.混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,错误。c.可逆反应到达平衡时,反应混合物各组分的浓度不发生变化,反应容器中N2的物质的量浓度不再发生变化,说明到达平衡,故c正确。d.单位时间内断开a个H-H键的同时形成3a个N-H键,都表示正反应速率,不能说明到达平衡,错误。e.反应混合物平衡时的浓度之比与起始浓度及转化率有关,平衡时可能等于化学计量数之比,也可能不等于,错误。
(2)①、N2是反应物,结合化学方程式分析,H2的曲线变化快,而N2的变化慢,所以表示N2的浓度变化的曲线是C。
②、根据v=△c÷t公式计算可得,前25 min 内,用H2的浓度变化表示的化学反应平均速率是0.12mol/(L·min) 。
③、平衡常数等于生应物的幂之积除以反应物的幂之积,故平衡常数K?=4/27。反应为放热反应,升高温度,反应逆向移动,故若升高温度,该反应的平衡常数值将减小。
(3)升高反应温度,平衡逆向移动,氢气的浓度增加1.5 mol·L-1,氨气减少1 mol·L-1,变为1.0mol·L-1画出曲线即可。
(4)设平衡时有x molN2转化?
N2(g)+3H2(g)) ?2NH3(g)
?2NH3(g)
起始物质的量:1mol? 3mol? 0
变化物质的量:x? 3x? 2x
平衡物质的量:1-x? 3-3x? 2x?
可得4-2x=2.8,得出x=0.6mol,α1?=60%;α1?+?α2?=1,说明这两个反应达到平衡时的状态完全相同,加入的氨气为2mol。
本题难度:困难
5、选择题 密闭容器中,反应xA(g)+yB(g) zC(g)达平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.2 mol·L-1.下列判断正确的是
zC(g)达平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.2 mol·L-1.下列判断正确的是
A.x+y<z
B.平衡向逆反应方向移动
C.B的转化率降低
D.C的体积分数减小
参考答案:A
本题解析:若平衡不移动,A的浓度应是0.25mol·L-1,故扩容减压后,平衡向消耗A的方向移动,即正向移动,x+y<z,B的转化率增大,C的体积分数增大,答案为A
本题难度:一般