1、选择题 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) bZ(g)
bZ(g) 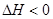 。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
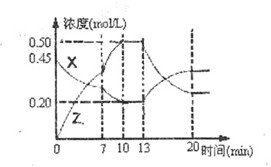
根据以上信息判断,下列说法中正确的是?(?)
A.用X表示0~10 min内该反应的平均速率为v(x)=0.045mol/(L·min)
B.化学方程式中a:b=1:3
C.推测在第7min时曲线变化的原因可能是升温
D.推测在第13min时该反应刚好达到化学平衡
参考答案:C
本题解析:A错,用X表示0~10 min内该反应的平均速率为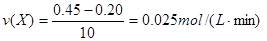 ;B错,化学方程式的化学计量数比等于物质的量的变化比,所以化学方程式中a:b=1:2;C正确,该反应的正反应方向为放热反应,升温平衡向逆反应方向移动,X的浓度增大,Z的浓度减小;D错,可逆反应达到平衡状态后,体系内各组分的浓度保持不变;
;B错,化学方程式的化学计量数比等于物质的量的变化比,所以化学方程式中a:b=1:2;C正确,该反应的正反应方向为放热反应,升温平衡向逆反应方向移动,X的浓度增大,Z的浓度减小;D错,可逆反应达到平衡状态后,体系内各组分的浓度保持不变;
本题难度:一般
2、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是?
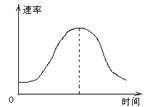 ?
?
A.①④
B.③④
C.①②③
D.②③
参考答案:C
本题解析:试题分析:镁和盐酸反应生成氯化镁和氢气,所以影响该反应速率的因素有温度、氢离子的浓度、镁条的表面积。氯离子在反应前后是不变的,不会影响反应速率,答案选C。
考点:考查外界条件对反应速率影响的判断
点评:该题是高考中的常见考点,属于基础性知识的检验和训练,侧重对学生基础知识的巩固,有利于提高学生灵活运用基础知识解决实际问题的能力。该题的关键是记住影响反应速率的外界条件,并能灵活运用即可。
本题难度:困难
3、选择题 已知2SO2(g)+O2(g)  2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
A.在2 min内,v(SO2)=0.25 mol·L-1·min-1
B.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小
C.在1 min时,c(SO2)+c(SO3)=0.01 mol·L-1
D.若恒温恒压下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,平衡后反应放热小于0.025a kJ
参考答案:C
本题解析:A项,在2 min内,v(SO2)=0.002 5 mol·L-1·min-1;B项,“再充入0.1 mol SO3”等同于“再充入0.1 mol SO2和0.05 mol O2”,此时相当于加压,反应物平衡转化率提高,达到平衡后SO3的质量分数增大;C项,根据硫原子守恒,该反应体系中任何时刻都有c(SO2)+c(SO3)=0.01 mol·L-1;D项,2SO2(g)+O2(g)?2SO3(g)的正反应是一个气体物质的量减小的反应,在恒温恒容条件下,随着反应正向进行,容器内的压强减小,而恒温恒压条件下则相当于在原恒温恒容反应体系的基础上加压,反应物的平衡转化率提高,平衡后反应放热大于0.025a kJ。
本题难度:一般
4、选择题 对于可逆反应? 2AB3(g)
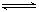 ?A2(g) + 3B2(g) ; ΔH>0,下列图像正确的是
?A2(g) + 3B2(g) ; ΔH>0,下列图像正确的是
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (10分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=?;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=?;反应的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| ?
|
从上表可以推断:此反应是?(填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为?。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有?(填实验编号);
实验编号
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
|
A
| 1
| 5
| 2
| 3
|
B
| 2
| 2
| 1
| 1
|
C
| 0.5
| 2
| 1
| 1
|
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是?。
①体系的压强不再发生变化?②混合气体的密度不变
③混合气体的平均相对分子质量不变?④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化?⑥v(CO2)正=v(H2O)逆
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种)?。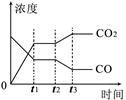
参考答案:(1)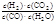 (1分)?放(1分)? 50%(2分)?
(1分)?放(1分)? 50%(2分)?
(2)B(2分)?
(3)④⑤⑥(2分)?
(4)降低温度,或增加水蒸汽的量,或减少氢气的量(2分)
本题解析:(1)分析表格数据,得:升温K值减小,即平衡逆向移动,说明逆向是吸热反应,则正向为放热反应;
830℃? CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
n0? 1mo1? 1mo1? 0? 0
n? x? x? x? x
n(平衡)1-x? 1-x? x? x
则K=x2/(1-x)2=1,求解,得:x="0.5" mo1
所以,达到平衡后CO的转化率=x/1mo1=50%;
(2)利用Q与K的关系求解;利用Q=[C(H2)C(CO2)]/[C(CO)C(H2O)],依次求得Q(A)=1.2、Q(B)=0.25、Q(C)=1;要正向进行,则Q<K,故选B;
(3)因反应前后气态物质系数相等,则无论是否达平衡态,压强都不变,故①不是反应达到平衡的标志;②混合气体的密度=m(气体)/V,因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,“固定容积的容器”则V为一定值,故②不是反应达到平衡的标志;③混合气体的平均相对分子质量= m(气体)/n(气体),因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,由化学方程式系数得:无论是否达平衡态,n(气体)为一定值,故③不是反应达到平衡的标志;④是;⑤该反应为放热反应,则体系的温度不变,说明达到了平衡态;⑥是;
(4)分析图像可以看出:在t2时刻,因条件的改变使C(CO2)增大、C(CO)减小,说明平衡正向移动;但不能是增大C(CO)使平衡正向移动(因增大C(CO),能使平衡正向移动,C(CO2)增大,但C(CO)也增大)
本题难度:一般