1、选择题 某混合液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3。已知下表数据:
物质(25℃)
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
Ksp
| 2.2×10-20
| 8.0×10-16
| 4.0×10-38
|
完全沉淀时的pH
| ≥6.4
| ≥9.6
| 3~4
|
下列叙述正确的是
A.混合溶液中:c(SO42-):[ c(Cu2+) +c(Fe3+) +c(Fe2+)]=5:4
B.若向混合溶液中加入铁粉,不可能观察到红色固体析出
C.若向混合溶液中加入足量氯水,调节pH到3~4后过滤,得到纯净的CuSO4溶液
D.若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(OH)3沉淀
参考答案:D
本题解析:A、设各物质的物质的量浓度均是1mol/L,则混合 溶液中:c(SO42-)=1+1+3=5mol/L,c(Cu2+) +c(Fe3+) +c(Fe2+)=1+1+2=4mol/L,但金属阳离子水解使总浓度小于4mol/L,所以c(SO42-):[ c(Cu2+) +c(Fe3+) +c(Fe2+)]>5:4,错误;B、向混合液中加入铁粉,铁先与铁离子反应生成亚铁离子,若铁有剩余,则铁与铜离子反应生成铜单质,所以可能观察到红色固体析出,错误;C、若向混合溶液中加入足量氯水,亚铁离子转化为铁离子,调节pH到3~4后铁离子完全沉淀,过滤,此时溶液中存在铜离子、氯离子、硫酸根离子,所以不可能得到纯净的CuSO4溶液,错误;D、根据阳离子沉淀的pH可知,向溶液中滴入氢氧化钠溶液时,铁离子先沉淀生成氢氧化铁,正确,答案选D。
考点:考查氧化还原反应的顺序的判断,水解应用,离子沉淀的分析判断
本题难度:一般
2、实验题 (18分)铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
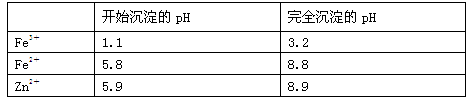
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
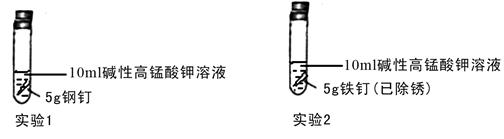
①完成下列表格

②实验2比实验1能够较快看到以上现象的原因是 。
参考答案:(1)第四周期 第VIII族 (2分) 3CO + Fe2O3 2Fe +3 CO2(2分)
2Fe +3 CO2(2分)
(2)②向沸水中逐滴加入5-6滴FeCl3饱和溶液 (2分)
③液体呈透明的红褐色 (1分)
(3)将Fe2+氧化为Fe3+,(2分)至3.2-5.8之间 (1分) HCO3-(2分)
(4)①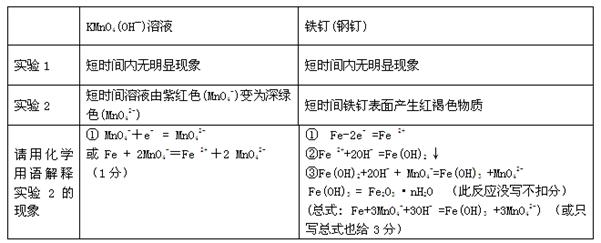
(每道方程式1分,共4分)
②铁钉中的碳和铁构成了原电池的正负极,加快反应速率,能发生电化学腐蚀 (2分)
本题解析:铁元素是第四周期,第VIII族元素,工业上通常采用高炉炼铁的方法制得单质铁:3CO + Fe2O3 2Fe +3 CO2;(2)实验室制备Fe(OH)3胶体的操作步骤为:①取25ml蒸馏水加热至沸腾;②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体;④停止加热。(3)含有Fe2+、Fe3+、Zn2+、SO42-的溶液中,要使溶液中的Fe2+和Fe3+完全沉淀,先往溶液中加入H2O2将Fe2+氧化为Fe3+,然后再加入NH4HCO3调节pH至3.2 以上使Fe3+完全沉淀,但pH<5.9,防止Zn2+转化为沉淀;加入NH4HCO3是使溶液中的H+离子浓度降低,故起调节pH作用的离子是HCO3- ;(4) ①钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上MnO4-得电子发生还原反应,电极反应式为MnO4-+e- = MnO42-,短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-),随后Fe 2++2OH- =Fe(OH)2 ↓;Fe(OH)2+2OH- + MnO4-=Fe(OH)3 +MnO42-;Fe(OH)3 = Fe2O3 ·nH2O等反应进行,因此可知:
2Fe +3 CO2;(2)实验室制备Fe(OH)3胶体的操作步骤为:①取25ml蒸馏水加热至沸腾;②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体;④停止加热。(3)含有Fe2+、Fe3+、Zn2+、SO42-的溶液中,要使溶液中的Fe2+和Fe3+完全沉淀,先往溶液中加入H2O2将Fe2+氧化为Fe3+,然后再加入NH4HCO3调节pH至3.2 以上使Fe3+完全沉淀,但pH<5.9,防止Zn2+转化为沉淀;加入NH4HCO3是使溶液中的H+离子浓度降低,故起调节pH作用的离子是HCO3- ;(4) ①钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上MnO4-得电子发生还原反应,电极反应式为MnO4-+e- = MnO42-,短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-),随后Fe 2++2OH- =Fe(OH)2 ↓;Fe(OH)2+2OH- + MnO4-=Fe(OH)3 +MnO42-;Fe(OH)3 = Fe2O3 ·nH2O等反应进行,因此可知:

②实验2比实验1能够较快看到以上现象的原因是:铁钉中的碳和铁构成了原电池的正负极,加快反应速率,能发生电化学腐蚀。
考点:考查铁及其化合物的性质,胶体,电化学腐蚀的探究实验设计。
本题难度:一般
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)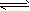 Mg2++2OH-,若使固体Mg(OH)2的量减少,而c(Mg2+)不变,可采取的措施是
Mg2++2OH-,若使固体Mg(OH)2的量减少,而c(Mg2+)不变,可采取的措施是
[? ]
A.加MgCl2
B.加H2O
C.加NaOH
D.加HCl
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.溶度积常数大者,溶解度也大
B.由于AgCl水溶液导电性很弱,所以它是弱电解质
C.难溶电解质离子浓度的乘积就是该物质的溶度积常数
D.难溶电解质的溶度积常数与温度有关
参考答案:A、因同一类型的沉淀,溶度积常数大者,溶解度也大,不同类型的不存在此关系,故A错误;
B、因电解质的强弱与水溶液的导电性无关,与电离程度的大小有关,故B错误;
C、难溶电解质溶度积常数在饱和溶液中各离子浓度幂的乘积,故C错误;
D、难溶电解质的溶度积常数与温度有关,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列说法正确的是(? )
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH)
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.AgCl沉淀易转化成AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)
参考答案:D
本题解析:SO3溶于水后能导电,是因为SO3与水反应生成了强电解质H2SO4,H2SO4溶液能导电,故A项错误;醋酸与氢氧化钠反应生成醋酸钠,醋酸钠水解显碱性,所以pH=7时,醋酸要过量,醋酸溶液的体积大一些,故B项错误;NaAlO2与NaHCO3反应只生成Al(OH)3沉淀,故C项错误;AgCl沉淀易转化为AgI沉淀,说明AgI更难溶,故D项正确。
【考点定位】本题考查电解质、酸碱中和滴定、盐类水解、物质间的反应和沉淀的转化。
本题难度:简单