1、选择题 已知298 K时下列物质的溶度积(单位略)。
?
| CH3COOAg
| AgCl
| Ag2CrO4
| Ag2S
|
Ksp
| 2.3×10-3
| 1.77×10-10
| 1.12×10-12
| 6.7×10-15
|
?
下列说法正确的是
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的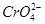 和Cl-的溶液中慢慢滴入AgNO3溶液时,
和Cl-的溶液中慢慢滴入AgNO3溶液时,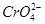 先沉淀
先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
参考答案:C
本题解析:Ksp(CH3COOAg)>Ksp(AgCl),向CH3COOAg悬浊液中加入盐酸时CH3COOAg转化为AgCl,离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl,C正确。
本题难度:一般
2、选择题 已知几种难溶电解质的溶度积常数(25℃)见下表

下列对AgCl、AgBr、AgI、Ag2SO4、Ag2CrO4叙述不正确的是
[? ]
A.Ksp的大小与三种卤化银见光分解的难易无关
B.将等体积的4×10-3 mol·L-1的AgNO3和4×10-3 mol·L-1 K2CrO4混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液
D.向100mL0.1mol·L-1的Na2SO4溶液中加入1mL0.1mol·L-1的AgNO3溶液,有白色沉淀生成
参考答案:D
本题解析:
本题难度:一般
3、填空题 (10分)请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
参考答案:(1) Fe2O3 (2) ④>②>①>③
(3) CH3COO-+H2O CH3COOH+OH-; c(Na+)>c(CH3COO-)>c(OH-)>c(H+) (4) 8
CH3COOH+OH-; c(Na+)>c(CH3COO-)>c(OH-)>c(H+) (4) 8
本题解析:(1)加入氯化铁溶液,会促进水解,HCl不断挥发,导致最终得到Fe(OH)3,灼烧后得Fe2O3 ,(2)比较离子的浓度大小,分析物质的组成,且盐类的水解程度微弱,所以NH4+的离子浓度最大的是④,①中发生双水解,离子浓度最小,②中H+抑制水解,③电离程度小,所以离子浓度最小。(4)由已知条件确定该温度下水的离子积为10-12,当则R2+沉淀完全时,离子浓度小于10-5,结合物R(OH)2的Ksp = 1×10-13,c(OH-)=10-4mol/L,c(H+)=Kw/c(OH-)=10-8mol/L,所以pH为8.
考点:盐类的水解、离子浓度的大小比较、溶度积的计算。
本题难度:一般
4、选择题 下列化学实验事实及其解释或结论都正确的是
[? ]
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.向1?mL?1%的NaOH溶液中加入2?mL?2%的CuSO4溶液,振荡后再加入0.5?mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基
C.向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI
D.向浓度均为0.1?mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]?>Ksp[Mg(OH)2]
参考答案:C
本题解析:
本题难度:一般
5、填空题 已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)==?1.8×10-10,Ksp(AgY)==?1.0×10-12,Ksp(AgZ)==?8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(以被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:? _______________
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)?
(填“增大”、“减小”或“不变”)。
(3)由上述Ksp判断,在上述(2)的体系中,能否实现AgY向AgZ的转化,并简述理由:? _______
参考答案:
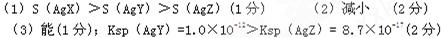
本题解析:略
本题难度:一般