1、选择题 下列条件一定能使反应速率增大的是 ①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④不断分离出生成物 ⑤加入MnO2
[? ]
A.②
B.②③
C.①②⑤
D.全部
参考答案:A
本题解析:
本题难度:一般
2、选择题 2SO2(g)+O2(g)  ?2SO3(g) 是制备硫酸的重要反应。下列叙述正确的是
?2SO3(g) 是制备硫酸的重要反应。下列叙述正确的是
[? ]
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是C1、C2,则时间间隔t1-t2内,SO3(g)生成的平均速率为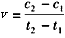
参考答案:D
本题解析:
本题难度:一般
3、填空题 在一个体积为1 L的密闭容器中发生某化学反应:2A(g) B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
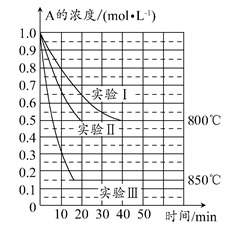
试回答下列问题:
(1)在实验Ⅰ中,反应在20~40 min内A的平均反应速率为________mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是________________。
(2)该反应的ΔH________0,其判断理由是________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L-1? B.0.4 mol·L-1? C.0.7 mol·L-1? D.0.8 mol·L-1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应________。
A.等于86%? B.等于50%
C.小于50%? D.介于50%~86%之间
参考答案:(1) 7.5×10-3 实验Ⅱ中使用了催化剂
(2)> 根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向正反应方向移动,该反应为吸热反应
(3)AB (4)B
本题解析:(1)在实验Ⅰ中,反应在20~40 min内A的平均反应速率为:
v(A)= =7.5×10-3 mol·L-1·min-1。
=7.5×10-3 mol·L-1·min-1。
实验Ⅱ和实验Ⅰ的平衡状态相同,且在实验Ⅱ中的反应速率更快,说明实验Ⅱ中使用了催化剂。
(2)实验Ⅲ和实验Ⅰ相比较,温度升高,A的平衡浓度减小,说明正反应是吸热反应,降低温度,化学平衡向逆反应方向移动。
(3)实验Ⅰ在第40 min末,A的平衡浓度为0.5 mol·L-1,降低温度,化学平衡向逆反应方向移动,达到新的平衡时,A的浓度必大于0.5 mol·L-1,不可能是AB。
(4)根据800°C时A的起始浓度为1.0 mol·L-1,达到平衡时A的浓度为0.5 mol·L-1,说明A的转化率为50%。若加入1 mol A和0.2 mol He,则使压强增大,因为是恒容条件,稀有气体对平衡无影响,则转化率仍为50%。
本题难度:一般
4、填空题 用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。

(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A.蒸馏水
B.NaCl固体
C.NaCl溶液
D.浓盐酸