| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《反应速率与平衡的有关计算》高频考点巩固(2017年模拟版)(二)
参考答案:(1)H2?(2)0.05?mol/ (L·min)?(3)D(4)放热,?92kJ 本题解析:(1)根据图像可知,反应进行到2min时XYZ的浓度不再发生变化,反应达到平衡状态。此时Z的物质的量增加了0.2mol,X的物质的量减少了0.3mol,Y的物质的量减少了0.1mol,所以图中X曲线代表氢气。 本题难度:一般 2、选择题 对可逆反应2A(s)+3B(g) 参考答案:B 本题解析:A是固体,增加A的质量,反应速率和平衡都不变,①不正确。升高温度或增大压强,反应速率一定是增大的,②③不正确。增大B的浓度,v(正)>v(逆),平衡向正反应方向移动,④正确。催化剂只能改变反应速率,但不能影响平衡状态,转化率不变,⑤不正确,所以答案选B。 本题难度:一般 3、填空题 加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。 参考答案: (1)2H2O2 本题解析: 本题难度:一般 4、填空题 (14分)Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。 |
 2SO3(g)? ΔH=" —196.6" kJ·mol―1
2SO3(g)? ΔH=" —196.6" kJ·mol―1 2NO2(g)? ΔH= —113.0 kJ·mol―1
2NO2(g)? ΔH= —113.0 kJ·mol―1 SO3(g) + NO(g) 的ΔH= ??。
SO3(g) + NO(g) 的ΔH= ??。参考答案:
理科综合试卷·第1页(共16页)
 ?CH3OH + H2O(2分)② 0.225 (1分)? ③ 75%?(1分)? < (1分)? ④ C(1分)
?CH3OH + H2O(2分)② 0.225 (1分)? ③ 75%?(1分)? < (1分)? ④ C(1分)本题解析:I.(1)① 根据反应物和生成物可知,方程式为 CO2 + 3H2 ?CH3OH + H2O。
?CH3OH + H2O。
②平衡时生成甲醇是0.75mol/L,所以根据方程式可知,消耗氢气是0.75mol/L×3=2.25mol/L,因此其反应速率是2.25mol/L÷10min=0.225 。
。
③根据图像可知,消耗CO2是0.75mol/L,素其转化率是0.75mol/L÷1.0mol/L×100%=75%。温度降低时CO2的转化率变大,说明降低温度平衡向正反应方向移动,所以正反应是放热反应。
④升高温度平衡向逆反应方向移动,n(CH3OH)/n(CO2)降低,A不正确。充入氮气,平衡不移动,B不正确。将水蒸气从体系中分离,相当于降低生成物浓度,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大,C周期。催化剂不能影响平衡状态,D不正确,答案选C。
(2)原电池中负极失去电子,所以甲醇在负极通入。由于电解质溶液显碱性,所以负极电极反应式为CH3OH-6 e- + 8OH- =CO32-?+?6H2O
II.(1)考查盖斯定律的应用。(①-②)÷2即得到O2(g) + SO2(g) SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1.
SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1.
(2)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以b正确。反应前后羰基不变,所以压强也是随着不变的,a不正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以c不正确。d中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。答案选bd。
②?NO2(g) + SO2(g) SO3(g) + NO(g)
SO3(g) + NO(g)
起始量(mol)? 1? 2? 0? 0
转化量(mol)? x? x? x? x
平衡量(mol)? 1-x? 2-x? x? x
所以有(1-x)︰(2-x)=1︰6,解得x=0.8,所以平衡常数是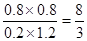 。
。
本题难度:一般
5、选择题 现有3个体积相等的密闭容器。都进行下列反应:CO2(g)+H2(g) ?H2O(g)+CO(g),反应所处的温度相同,但起始浓度不同。其中甲:CO2 = H2 =" a" mol;乙:CO2 =" a" mol ,H2 =" 2a" mol ;丙:CO2 =H2 =H2O(g)=" a" mol 。达到平衡时,CO2的物质的量由大到小的顺序是
?H2O(g)+CO(g),反应所处的温度相同,但起始浓度不同。其中甲:CO2 = H2 =" a" mol;乙:CO2 =" a" mol ,H2 =" 2a" mol ;丙:CO2 =H2 =H2O(g)=" a" mol 。达到平衡时,CO2的物质的量由大到小的顺序是
A.甲>乙>丙
B.甲>丙>乙
C.丙>甲>乙
D.乙>甲>丙
参考答案:C
本题解析:甲与乙比较,乙装置相当于在甲装置达到平衡后,再充入a mol H2 ,此时平衡将向正反应方向移动,其结果是CO2的物质的量减小,即可得平衡时CO2的物质的量甲>乙;丙装置相当于在甲装置达到平衡后,再充入a mol H2O(g),此时平衡将向逆反应方向移动,达到平衡后CO2的物质的量为丙>甲;
综上所述,达到平衡时,CO2的物质的量由大到小的顺序是丙>甲>乙,即C选项正确。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《无机综合与.. | |