1、简答题 将等物质的量浓度的A,B混合于2L的密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),经5分钟后,测D的浓度为0.5mol/L,C的平均反应速率为0.1mol(L?min)-1,c(A):c(B)=3:5,求:
(1)X的值;
(2)B的平均反应速率;
(3)开始时A,B的物质的量
(4)反应5分钟时A的浓度.
参考答案:D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
? ?3A(g)+B(g)=xC(g)+2D(g),
开始? ? ? n mol?n mol? ?0?0?
反应? ? 1.5mol? 0.5mol?1mol
5min? (n-1.5)mol?( n-0.5)mol? 1mol
c(A):c(B)=(n-1.5)mol?2L:(?n-0.5)mol?2L=3:5,
所以n=3,
(1)D的浓度为0.5mol/L,反应时间为5min,D的反应速率为0.1mol?L-1?min-1,C的反应速率是0.1mol?L-1?min-1,根据同一反应中,各物质的反应速率之比等于计量数之比,所以x=2,
答:X的值为2;
(2)反应速率之比等于化学计量数之比,x=2,则v(B)=12v(C)=12×0.1mol(L?min)-1=0.05mol(L?min)-1,
答:B的平均反应速率为0.05mol(L?min)-1;
(3)有以上分析可知开始时A,B的物质的量都为3mol,
答:开始时A,B的物质的量为3mol;
(4)在5min末的物质的量为:(n-1.5)mol=1.5mol,其物质的量浓度为1.5mol2L=0.75mol/L,
答:反应5分钟时A的浓度为0.75mol/L.
本题解析:
本题难度:一般
2、选择题 往一真空密闭容器中通入一定量的气体A,在一定温度下,发生如下反应:
2A(g)?B(g)+xC(g)反应达平衡时,测得容器内压强增大了p%,若此时A的转化率为a%,下列关系正确的是
①若x=1,则p>a?②若x=2,则p<a?③若x=3,则p=a?④若x=4,则p≥a( )
A.②③
B.①④
C.②③④
D.②④
参考答案:设开始时加入气体A的物质的量为1 mol,则由题意得?
? 2A(g)=B(g)+xC(g)?
起始量(mol):1? 0? 0
变化量(mol):a%?12?a%? x2?a%?
平衡量(mol):1-a%?12a%? x2?a%
?总:1-12a%+x2?a%
?由题意知:1-12a%+x2?a%=1+p%,解得,ax=a+2p
代入①②③④选项分析判断,
①若x=1,则p>a? ?ax=a+2p? p=0,压强不变,故①错误;
②若x=2,则p<a? p=0.5a? 则p<a,故②正确;
③若x=3,则p=a? ?p=a? ③故正确;
④若x=4,则p≥a? p=1.5a? 则p>a,故④错误;
综上所述:②③正确;
故选A.
本题解析:
本题难度:简单
3、填空题 二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
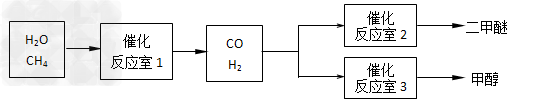
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g);△H>0。在其它条件不变的情况下降低温度,逆反应速率将 _____(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)=______ mol·L-1·min-1。
CO(g)+3H2(g);△H>0。在其它条件不变的情况下降低温度,逆反应速率将 _____(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)=______ mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为________ 。
(3)在压强为0.1MPa条件下,反应室3(容积为2L)中0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
① P1 _____P2 (填“<”、“>”或“=”)。
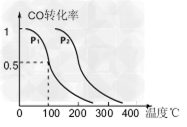
②在P1压强下,100℃时,反应CO(g)+2H2(g)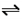 CH3OH(g)的平衡常数K的值为________,若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 ______(填“增大”、“不变”或“减小”),CH3OH的体积分数________(填“增大”、“不变”或“减小”)。
CH3OH(g)的平衡常数K的值为________,若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 ______(填“增大”、“不变”或“减小”),CH3OH的体积分数________(填“增大”、“不变”或“减小”)。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率______(填“增大”、“不变”或“减小”),c(CH3OH)_________ 0.1mol/L(填“>”、“<”或“ = ”)
参考答案:(1)减小;?0.03mol·L-1·min-1
(2)2CO+4H2 CH3OCH3+H2O
CH3OCH3+H2O
(3)① <;②100;减小;减小;③增大;>
本题解析:
本题难度:一般
4、计算题 (8分)往容积为10L的密闭容器内通入40molN2和120molH2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2mol/L。
(1)用H2的浓度变化表示2s内的平均速率为?。
(2)?氮气的转化率是?。?
(3)?平衡时混合气体中氨的体积分数是?。
(4)?容器内反应前后压强比是?。
参考答案:(1)3mol/(L·S)?(2)50%?(3)33.3%?(4)4∶3
本题解析:考查可逆反应的有关计算,一般采用三段式。
N2?+? 3H2 2NH3?
2NH3?
起始量(mol)? 40? 120? 0
转化量(mol)? 20? 60? 40
平衡量(mol)? 20? 60? 40
(1)用H2的浓度变化表示2s内的平均速率为
(2)氮气的转化率是20÷40×100%=50%
(3)平衡时混合气体中氨的体积分数是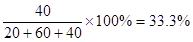
(4)容器内反应前后压强比是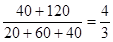
本题难度:一般
5、填空题 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的11/12,则N2的转化率α1_________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2_______α1(填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以5.1吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为_______吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+
CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
参考答案:(1)16.7%;>
(2)13.5
(3)由反应转化关系知,反应过程中钠元素守恒,设NaNO2和NaNO3的物质的量分别为4a mol和a mol,则4a+a=50mL×10-3 mL·L-1×1.0 mol·L-1×2,解得:a=0.02 mol,于是,推出NO、NO2的物质的量分别为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
本题解析:
本题难度:一般