1、计算题 一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
2、选择题
达到平衡后,下列说法中一定正确的是
A.平衡时,用A的浓度变化表示的正反应速率是用B的浓度变化表示的逆反应速率的a/b倍
B.保持容器内气体压强不变,再通入稀有气体,平衡不移动
C.保持容器体积不变,再通入一定量的C,建立新的平衡状态时,A的体积分数与原平衡时相同
D.保持容器体积不变,增加B的物质的量,建立新的平衡状态时,A的转化率升高
3、选择题 某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
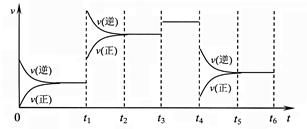
A.t1时升高了温度
B.t3时加入了催化剂
C.t5~t6时刻,Y转化率最小
D.在t3~t4时间内,X的体积分数最大
4、选择题 将4mol?A气体和2?mol?B气体在体积为2?L的密闭容器中混合,并在一定条件下发生如下反应:
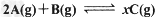 若经2?s后测得A的物质的量为2.8?mol,?C的浓度为0.6?mol/L。现有下列几种说法,其中正确的是?
若经2?s后测得A的物质的量为2.8?mol,?C的浓度为0.6?mol/L。现有下列几种说法,其中正确的是?
[? ]
①2s内用物质A表示的平均反应速率为0.3?mol/(L·s)
②2s内用物质B表示的平均反应速率为0.6?mol/(L·s)
③2s时物质B的转化率为70%
④x=2?
A.①③?
B.①④?
C.②③?
D.③④?
5、选择题 已知常温常压和催化剂条件下,N2(g)和H2(g)生成2 mol NH3(g)放出92.4 kJ的热量。在上述条件下向密闭容器中通入1 mol N2和3 mol H2,达到平衡时放出热量为Q1 kJ;向另一体积相同的容器中通入0.9 mol N2、2.7 mol H2和0.2 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是(? )
A.2Q=Q1="92.4"
B.Q2<Q1<92.4
C.Q1<Q2<92.4
D.Q1=Q2=92.4