1、实验题 氯化铁是常见的水处理剂。某氯化铁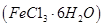 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

已知有关离子方程式为:
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:_____________________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯? b.10mL量筒? c.20mL量筒? d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准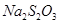 溶液18.00mL。该样品中
溶液18.00mL。该样品中 (式量为270.5)的质量分数为_____________。
(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量 杂质除去,可用的试剂是________(选填编号)。
杂质除去,可用的试剂是________(选填编号)。
a.铁粉? b.氯水? c.溴水? d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品?②加水溶解?③加足量氨水,沉淀?④过滤?⑤灼烧?⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作________________________;
判断是否恒重的标准是_______________________________________________________。
参考答案:(1)Fe3+ + 3H2O  ?Fe(OH)3 + 3H+(1分,等号也对,缺反应条件不得分)
?Fe(OH)3 + 3H+(1分,等号也对,缺反应条件不得分)
(2)100ml容量瓶(1分)、胶头滴管(1分)
(3)d(1分) 最后一滴标准液滴入时,锥形瓶中溶液由蓝色变为无色,且半分钟内不变色(1分)
(4)0.9738或97.38% (2分)
(5)bd (2分)
(6)洗涤 (1分)在上层清液中继续滴加氨水,观察有无沉淀产生(1分);连续两次称得的质量相等或不超过0.1g(1分)。
本题解析:(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,生成的是氢氧化铁胶体,反应的离子方程式为Fe3+ + 3H2O  ?Fe(OH)3 + 3H+
?Fe(OH)3 + 3H+
(2)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,故还必须有:100mL容量瓶;胶头滴管;
(3)100.00ml的溶液需要精密量具量取,烧杯是粗略量取,量筒只能精确到0.1ml,所以用滴定管精确到0.01ml,选用25mL滴定管量取溶液10.00ml的溶液,故d项正确;碘遇淀粉变蓝色,随标准Na2S2O3溶液滴入和碘单质反应,溶液蓝色变化为无色且半分钟不褪色,说明达到反应终点。
(4)2Fe3++2I-→2Fe2++I2,I2+2S2O32-→2I-+S4O62一,2FeCl3-6H2O~2Fe3+~I2~2S2O32-;滴定时,10.00ml溶液中碘单质消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.17mL,FeCl3?6H2O的物质的量=0.1000mol/L×0.018L=0.0018mol,该样品中100.00ml溶液中所含FeCl3?6H2O的物质的量为0.018mol,质量分数=0.018mol×270.5g/mol÷5.000g×100%=97.38%。
(5)要把样品氯化铁中的少量FeCl2杂质除去,需要加入氧化剂氧化亚铁离子为铁离子,但加入的氧化剂不能引入新的杂质。A、铁粉和铁离子反应,不能和 亚铁离子反应,不符合;
b、氯水可以氧化亚铁离子为铁离子,且不引入新的杂质,符合;c、溴水能氧化亚铁离子,但引入了溴离子,不符合;d、双氧水可以氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,符合。
(6)实验操作过程分析沉淀需要过滤后洗涤除去表面的杂质;检验是否沉淀完全,可以在上层清液中加入氨水观察是否有沉淀生成;沉淀称量恒重的标准是两次称量质量相同或相差不超过0.001g。
本题难度:一般
2、选择题 有关物质的转化关系如下图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色。下列有关判断正确的是

A. X固体可能是碘单质
B. 图中所示反应均为氧化还原反应
C. 1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数)
D. E、H、I溶液配制时,均需加酸防止其水解
参考答案:B
本题解析:H溶液呈浅绿色含亚铁离子,I溶液呈棕黄色含Fe3+,X固体为还原剂,而碘单质无法将Fe3+还原为Fe2+,故A错误;C气体为强氧化性气体,1mol C与H溶液完全反应转移电子数不一定为NA,若为氯气则为2NA,故C错误;E可能为稀的强酸溶液如盐酸,则无需防止其水解,D错误;图中所示H、I溶液的转化反应为氧化还原反应,E转化为H需加还原剂X,也是氧化还原反应,答案选B。
本题难度:一般
3、计算题 把12.6g的镁铝合金的粉末放入过量盐酸中,得到13.44L气体(标况下)。试计算:
(1)该合金中铝的质量分数
(2)该合金中镁和铝的物质的量之比
参考答案:(1)W(Al) = 42.9%
(2)n(Mg): n(Al)="0." 3: 0. 2=3:2
本题解析:设合金中镁和铝的物质的量分别为X mol,Y mol,
n(H2)=" 13.44/22.4" =" 0.6" mol
Mg+2H+===Mg2++H2↑
1 mol 1 mol
X mol Xmol
2Al+6H+===2Al3++3H2↑
2 mol ? 3 mol
Y mol 1.5 Y mol

(1)W(Al)= 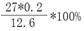 = 42.9%
= 42.9%
(2)n(Mg): n(Al)="0." 3: 0. 2=3:2
本题难度:简单
4、填空题 用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物组成是①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4中的 ,其物质的量之比为 。?
参考答案:①或③ 1∶2或1∶1
本题解析:混合物中Fe、O原子个数比为: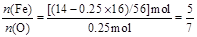
则两种化合物中,必有一种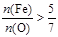 ,另一种
,另一种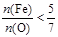 ,故混合物是①或③,物质的量之比为1∶2或1∶1。
,故混合物是①或③,物质的量之比为1∶2或1∶1。
本题难度:一般
5、选择题 欲证明某溶液中含有Fe3+,下列方法正确的是
A.加入铁粉
B.滴加稀硫酸
C.滴加氯水
D.滴加KSCN溶液
参考答案:D
本题解析:检验铁离子的常用试剂是KSCN溶液,所以答案选D。
点评:常见离子的检验方法
一、常见阳离子的检验
1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
二、常见阴离子的检验
1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水。
3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。
4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。②加入氯水和淀粉试液,溶液变蓝。
5、 SO42-:加入BaCl2溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
6、 SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色。②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2)。
7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的Pb(NO3)2试纸变黑。②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS或CuS)。
8、 CO32-:①加入CaCl2或BaCl2溶液,生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊。②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀。
9、 HCO3-:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,无明显现象。
10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味的气体(NO2)。
本题难度:简单