1、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
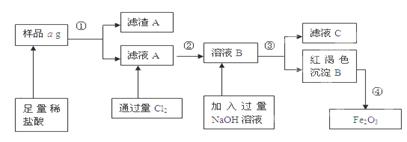
(1)滤液C中溶质含有_? _(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+____?_____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___?__。
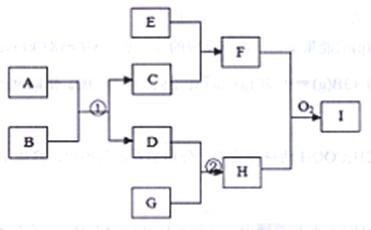
2、填空题 (12分)已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,磁性黑色物质C是某金属矿物的主要成份,E是一种非氧化性酸,F是混合物,H是极易溶于水的碱性气体。
请回答下列问题:
(1)写出下列物质的化学式:A?、C?、I?
(2)写出反应①的化学方程式:?
写出生成混合物F的离子方程式:?
(3)在一定温度、压强和有催化剂存在的条件下将l mol G和2,5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,
①则用G表示20min内的平均反应速率为:____
该温度下此反应的平衡常数K=?,D的转化率为?
②如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将?(填“升高”、“不变”或“降低”),再次平衡后H的体积分数为____?。
3、填空题 磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4溶液)制备磁材氧化铁的步骤如下:
①向下脚料(含大量FeSO4溶液)中加入少量2 mo1·L-1叫H2SO4和铁皮;
②向①中所得溶液中加絮凝剂和水,经过滤除去吸附了杂质的絮凝剂;
③将②所得的滤液浓缩结晶得到晶体A;
④将晶体A溶于水,并加入NH4HCO3,产生CO2气体同时得到FeCO3沉淀和无色溶液C;
⑤将FeCO3沉淀洗涤、烘干并煅烧。(煅烧中的变化为:FeCO3="FeO+CO2↑;?" 4FeO+O2="2" Fe2O3)
据上述信息回答下列问题:
(1)用18.4mo1·L-1的H2SO4配制500mL 2 mo1·L-1H2SO4,所需玻璃仪器除
??mL量筒、玻璃棒、烧杯、500mI。容量瓶外,还需要?。
(2)步骤①中2 mo1·L-1H2SO4和铁皮的作用分别为?。
(3)晶体A的化学式为?,检验溶液C中溶质阳离子的方法是?。
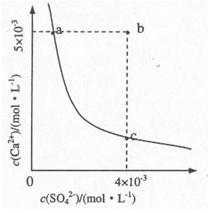
(4)向溶液C中加入CaCl2溶液能得到CaSO4沉淀,常温下KSP(CaSO4)=9x10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。
①a点对应的KSP?c点对应的KSP填“大于”、“小于”或“等于”);
②若由b点变到a点下列措施可行的是??。
A.加入适量CaCl2
B.加入适量BaCl2.
C.加人适量Na2SO4
D.蒸发
4、简答题 (13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80"c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
5、计算题 金属铜能被FeCl3的浓溶液腐蚀,其化学反应是:Cu+2FeCl3=2FeCl2+CuCl2。
 现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
 (1)溶液中存在那些离子?
(1)溶液中存在那些离子?
 (2)离子的浓度各是多少?(设溶液体积不变)
(2)离子的浓度各是多少?(设溶液体积不变)