1、实验题 氯化铁是常见的水处理剂。某氯化铁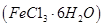 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

已知有关离子方程式为:
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:_____________________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯? b.10mL量筒? c.20mL量筒? d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准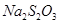 溶液18.00mL。该样品中
溶液18.00mL。该样品中 (式量为270.5)的质量分数为_____________。
(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量 杂质除去,可用的试剂是________(选填编号)。
杂质除去,可用的试剂是________(选填编号)。
a.铁粉? b.氯水? c.溴水? d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品?②加水溶解?③加足量氨水,沉淀?④过滤?⑤灼烧?⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作________________________;
判断是否恒重的标准是_______________________________________________________。
2、选择题 有关物质的转化关系如下图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色。下列有关判断正确的是

A. X固体可能是碘单质
B. 图中所示反应均为氧化还原反应
C. 1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数)
D. E、H、I溶液配制时,均需加酸防止其水解
3、计算题 把12.6g的镁铝合金的粉末放入过量盐酸中,得到13.44L气体(标况下)。试计算:
(1)该合金中铝的质量分数
(2)该合金中镁和铝的物质的量之比
4、填空题 用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物组成是①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4中的 ,其物质的量之比为 。?
5、选择题 欲证明某溶液中含有Fe3+,下列方法正确的是
A.加入铁粉
B.滴加稀硫酸
C.滴加氯水
D.滴加KSCN溶液