1、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
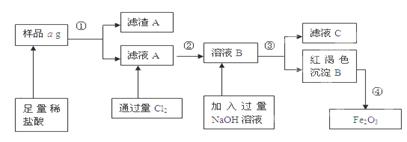
(1)滤液C中溶质含有_? _(写化学式);
(2)如何验证滤液A中含Fe2+,而不含Fe3+____?_____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___?__。
参考答案:(1)NaAlO2、NaCl、NaOH (2)取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色。 (3)(7b/10a)×100%
本题解析:(1)样品中加入足量的稀盐酸发生的反应为Fe + 2HCl=FeCl2 + H2↑;2Al+6HCl=2AlCl3+3H2↑滤液中含有FeCl2和AlCl3,滤渣中含有Cu等难溶性杂质。向滤液中通入过量的氯气发生反应2FeCl2+Cl2="=" 2FeCl3,再向溶液中加入过量的NaOH溶液时发生反应AlCl3+4NaOH=3NaCl+NaAlO2+2H2O. FeCl3+3NaOH =3NaCl+Fe(OH)3↓.过滤得到的滤液C中含有NaCl、NaAlO2、NaOH。红褐色沉淀为Fe(OH)3。将其灼烧分解得到Fe2O3和水。(2)验证滤液A中含Fe2+,而不含Fe3+的方法是取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,再加氯水(或通氯气),溶液变为血红色。或加入氢氧化钠溶液首先产生白色沉淀。白色沉淀迅速变为灰绿色,最后变为红褐色。(3)n(Fe2O3)=bg÷160g/mol.n(Fe)=2×n(Fe2O3)=b/80mol.所以该样品中铁元素质量分数为(b/80mol×56g/mol)÷ag×100%="(7b/10a)×100%" .?3+的检验等知识。
本题难度:一般
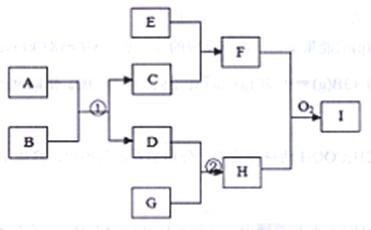
2、填空题 (12分)已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,磁性黑色物质C是某金属矿物的主要成份,E是一种非氧化性酸,F是混合物,H是极易溶于水的碱性气体。
请回答下列问题:
(1)写出下列物质的化学式:A?、C?、I?
(2)写出反应①的化学方程式:?
写出生成混合物F的离子方程式:?
(3)在一定温度、压强和有催化剂存在的条件下将l mol G和2,5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,
①则用G表示20min内的平均反应速率为:____
该温度下此反应的平衡常数K=?,D的转化率为?
②如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将?(填“升高”、“不变”或“降低”),再次平衡后H的体积分数为____?。
参考答案:12分)⑴ A?Fe?、C?Fe3O4?、I ?Fe(OH)3?
△
⑵?3Fe + 4H2O(g)? ="?" Fe3O4 + 4H2↑
Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
⑶① ?0.05mol/(L·min)?K="?" 0.5? L2/mol2?(平衡常数单位可以不作采分点),D的转化率为?60%?
②?不变,40%。
本题解析:略
本题难度:一般
3、填空题 磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4溶液)制备磁材氧化铁的步骤如下:
①向下脚料(含大量FeSO4溶液)中加入少量2 mo1·L-1叫H2SO4和铁皮;
②向①中所得溶液中加絮凝剂和水,经过滤除去吸附了杂质的絮凝剂;
③将②所得的滤液浓缩结晶得到晶体A;
④将晶体A溶于水,并加入NH4HCO3,产生CO2气体同时得到FeCO3沉淀和无色溶液C;
⑤将FeCO3沉淀洗涤、烘干并煅烧。(煅烧中的变化为:FeCO3="FeO+CO2↑;?" 4FeO+O2="2" Fe2O3)
据上述信息回答下列问题:
(1)用18.4mo1·L-1的H2SO4配制500mL 2 mo1·L-1H2SO4,所需玻璃仪器除
??mL量筒、玻璃棒、烧杯、500mI。容量瓶外,还需要?。
(2)步骤①中2 mo1·L-1H2SO4和铁皮的作用分别为?。
(3)晶体A的化学式为?,检验溶液C中溶质阳离子的方法是?。
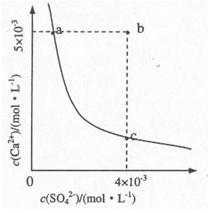
(4)向溶液C中加入CaCl2溶液能得到CaSO4沉淀,常温下KSP(CaSO4)=9x10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。
①a点对应的KSP?c点对应的KSP填“大于”、“小于”或“等于”);
②若由b点变到a点下列措施可行的是??。
A.加入适量CaCl2
B.加入适量BaCl2.
C.加人适量Na2SO4
D.蒸发
参考答案:(1)100,(2分)胶头滴管(1分)?(2)加2mol· 防止Fe
防止Fe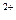 发生水解,(1分)?加铁皮防止Fe
发生水解,(1分)?加铁皮防止Fe 被氧化(1分)?(3)
被氧化(1分)?(3) ,(1分)取该溶液少许加入氢氧化钠溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明该溶液的阳离子为
,(1分)取该溶液少许加入氢氧化钠溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,证明该溶液的阳离子为 。(3分)?(4)等于,(2分)? A、B。(2分)
。(3分)?(4)等于,(2分)? A、B。(2分)
本题解析:略
本题难度:一般
4、简答题 (13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80"c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
参考答案:(13分)
(1)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (2)C(2分)
(3)Fe(OH)3+3HF=FeF3+3H2O(2分) (4)通风橱(或密闭容器)(2分)
(5)FeF3+3Li=Fe+3LiF(2分) (6)Fe4O5(或2FeO?Fe2O3)(3分)
本题解析:(1)H2O2把Fe2+氧化为Fe3+,在酸性条件下的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)步骤②加入了过量的氢氟酸溶液,玻璃和陶瓷中含有二氧化硅,而二氧化硅能与氢氟酸反应,所以A、B项错误,故C项正确。
(3)沉淀为Fe(OH)3,加入氢氟酸发生酸碱中和反应,化学方程式为:Fe(OH)3+3HF=FeF3+3H2O
(4)反应过程中,挥发出腐蚀性气体HF,所以从安全的角度考虑,在实验室里制三氟化铁时应在通风橱(或密闭容器)中进行。
(5)Li的活泼性大于Fe,所以三氟化铁与Li发生置换反应的化学方程式为:FeF3+3Li=Fe+3LiF
(6)Cl2的物质的量为0.672L÷22.4L/mol=0.03mol,Cl2氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为0.03mol×2=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为9.6g÷160g/mol=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,所以铁氧体样品含Fe2O3的物质的量为:0.03mol,所以该铁氧体的化学式为Fe4O5(或2FeO?Fe2O3)
本题难度:一般
5、计算题 金属铜能被FeCl3的浓溶液腐蚀,其化学反应是:Cu+2FeCl3=2FeCl2+CuCl2。
 现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
 (1)溶液中存在那些离子?
(1)溶液中存在那些离子?
 (2)离子的浓度各是多少?(设溶液体积不变)
(2)离子的浓度各是多少?(设溶液体积不变)
参考答案:(1)溶液中存在的离子为:Fe2+、Cu2+、Cl-。
 (2)Cu2+:0.625mol/L,Fe2+:5mol/L,Cl+11.25mol/L。
(2)Cu2+:0.625mol/L,Fe2+:5mol/L,Cl+11.25mol/L。
本题解析: 存在的不溶物有两种可能:一可能是铁、铜混合物,二可能只是铁。若为铁、铜混合物,则溶液中的Cu2+必然全部析出,即不溶物的质量大于9.6g,显然错误,故不溶物为Cu。
存在的不溶物有两种可能:一可能是铁、铜混合物,二可能只是铁。若为铁、铜混合物,则溶液中的Cu2+必然全部析出,即不溶物的质量大于9.6g,显然错误,故不溶物为Cu。
 所以:(1)溶液中存在的离子为:Fe2+、Cu2+、Cl-。
所以:(1)溶液中存在的离子为:Fe2+、Cu2+、Cl-。
 (2)溶液中n(Cu2+)=(9.6g-4.8g)÷64g/mol=0.075mol
(2)溶液中n(Cu2+)=(9.6g-4.8g)÷64g/mol=0.075mol
 Cu2+的物质的量浓度为:0.075mol÷0.12L=0.625mol/L
Cu2+的物质的量浓度为:0.075mol÷0.12L=0.625mol/L
 设被还原的Fe3+的物质的量为x:
设被还原的Fe3+的物质的量为x:
 根据Fe3+得电子数与Fe、Cu失电子数相等,列式为:
根据Fe3+得电子数与Fe、Cu失电子数相等,列式为:
 x×1=(8.4g÷56g/mol)×2+0.075mol×2=0.45mol
x×1=(8.4g÷56g/mol)×2+0.075mol×2=0.45mol
 溶液中n(Fe3+)=8.4g÷56g/mol+0.45mol=0.6mol
溶液中n(Fe3+)=8.4g÷56g/mol+0.45mol=0.6mol
 Fe2+的物质的量浓度为:0.6mol÷1.2L=5mol/L
Fe2+的物质的量浓度为:0.6mol÷1.2L=5mol/L
 Cl+的物质的量浓度为:0.625mol/L×2+5mol/L×2=11.25mol/L。
Cl+的物质的量浓度为:0.625mol/L×2+5mol/L×2=11.25mol/L。
本题难度:一般