1、选择题 在反应KClO3 + 6HCl="=" KCl +3Cl2↑+3H2O中,被氧化与被还原的氯原子个数比为(?)
A.1:6
B.6:1
C.1:5
D.5:1
参考答案:D
本题解析:略
本题难度:简单
2、填空题 (14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
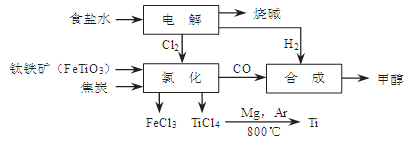
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式:?。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)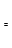 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将?(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是?。图中t3时改变的条件可能是?。
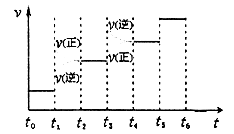
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
①写出甲中通入甲醇这一极的电极反应式?。
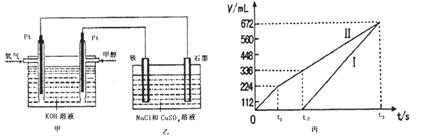
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式?,原混合溶液中NaCl的物质的量浓度为??mol/L。(假设溶液体积不变)
参考答案:⑴ 2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO(2分)
⑵① 向逆反应方向进行(2分)
②t2~t3?(2分)升高温度?(2分)
(3)①CH3OH-6e-+8OH-=CO32-+6H2O(2分)
②4OH--4e-=O2↑+2H2O (2分)? 0.1(2分)
本题解析:⑴据流程图,钛铁矿氯化过程中反应物有FeTiO3、C、Cl2、,生成物有FeCl3、TiCl4、CO,然后根据氧化还原反应的配平方法将其配平。
⑵①此时该反应的浓度商Qc=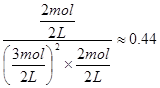 >0.27(K),说明反应向逆反应方向进行;
>0.27(K),说明反应向逆反应方向进行;
②结 合反应[CO(g)+2H2(g) CH3OH(g),正反应放热],并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。
CH3OH(g),正反应放热],并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。
⑶①装置甲为甲醇燃料电池,通入甲醇一极为负极,先根据得失电子守恒有CH3OH-6e-――CO32-,再根据电荷守恒有CH3OH-6e-+8OH―――CO32-,最后根据原子守恒得CH3OH-6e-+8OH-=CO32-+6H2O。
②装置乙为电解池,铁电极为阴极,该极发生的电极反应依次为Cu2++2e-=Cu,2H++2e-=H2↑;石墨为阳极,该极发生的电极反应式依次为2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O;据此可确定在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;根据在t1前发生的电极反应“2Cl--2e-=Cl2↑”可计算原混合溶液中NaCl的物质的量浓度: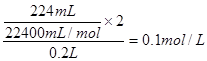 。
。
本题难度:一般
3、填空题 配平并完成方程式。
(1) Pt+? HNO3+? HCl ? H2PtCl6+? NO↑+? (? )
? H2PtCl6+? NO↑+? (? )
(2)Fe+? HNO3(稀) ? Fe(NO3)3+? NO↑+? H2O?被还原与未被还原的氮元素质量之比?。
? Fe(NO3)3+? NO↑+? H2O?被还原与未被还原的氮元素质量之比?。
(3)Cu2S+? HNO3 ? Cu(NO3)2+? NO↑+? S↓+? H2O
? Cu(NO3)2+? NO↑+? S↓+? H2O
被还原与未被还原硝酸物质的量之比是?被还原的元素是?。
参考答案:(1)3,4,18,3,4,8(H2O)
(2)1,4,1,1,2,1:3
(3)3,16,6,4,3,8,1:3,N
本题解析:略
本题难度:简单
4、简答题 古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:NaClO+NH3?H2O→N2H4+NaCl+H2O
(1)请配平上述化学方程式.并用单线桥法标出电子转移的方向和数目.
(2)NH3?H2O在上述反应中显示出来的性质是______.
A.氧化性?B.还原性?C.酸性?D.碱性
(3)该反应的氧化产物是______,NaClO发生______反应.
(4)若生成?0.2mol?N2H4,则转移的电子为______?mol.
参考答案:(1)一水合氨中的氮元素化合价由-3价升高到了-2价,失1mole-电子,次氯酸钠中氯元素化合价由+1价降低到了-1价,得2mole-电子,氧化还原反应中得失电子守恒,则配平情况电子转移的方向和数目为:

,故答案为:

;
(2)一水合氨中氮元素的化合价升高了,表现了还原性,故答案为:B;
(3)还原剂是一水合氨,对应的原产物是N2H4,次氯酸钠中氯元素化合价由+1价降低到了-1价,为氧化剂,发生了还原反应,故答案为:N2H4;还原;
(4)2mol一水合氨中的氮元素化合价由-3价升高到了-2价,失2mole-电子,次氯酸钠中氯元素化合价由+1价降低到了-1价,得2mole-电子,反应共转移2mol电子,生成1mol?N2H4,若生成?0.2mol?N2H4,转移0.4mol,电子,故答案为:0.4.
本题解析:
本题难度:一般
5、填空题 (12分)氧化还原是一类重要的反应。
(1)已知反应:①Cu+2Fe3+=Cu2++2Fe2+,②Cu2++Fe=Cu+Fe2+
反应①中还原剂是?,两个反应中各种离子的 氧化性从强到弱的顺序是?。
氧化性从强到弱的顺序是?。
(2)在反应MnO2+4HCI MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是?。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是?。
(3)已知反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
①铜与稀硝酸反应的离子方程式是?。
②下列物质中,放到铜粉和稀硫酸中,能实现铜粉溶解的是?。
A. KNO3? B. K2SO4? C. Cu(NO3)2
③a g铜粉与足量的某浓度HNO3溶液完全反应后,产生V L(标准状况)气体,反应中消耗的HNO3的物质的量是?。
参考答案:(1)还原剂是 Cu ?,顺序是Fe3+>Cu2+>Fe2+
(2)氯气的体积(标准状况)是2.24L
(3)①离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
②铜粉能溶解的是AC 。
③HNO3的物质的量是(a/32+V/22.4)mol
本题解析:略
本题难度:一般